[化学]三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设 l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_____________。筒述你的理由
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fe2O3和Cu2O的混合物,则其质量比为__ _,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中的烧瓶内固体不可以选用(选填序号)。
A.生石灰 B.碱石灰 C.五氧化二磷 D.烧碱
(2)B装置的用;E装置的作用。
(3)通入C装置的两根导管左边较长、右边较短,目的是。
(4)装置F中发生反应的化学方程式是。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
A、B、C、D四种元素均为短周期元素,A的最外层电子数为B最外层电子数的2倍,C的最高正价与最低负价的绝对值之差为2,A、B两元素形成的物质具有两性,C的最高价氧化物对应的水化物是强酸,D的最高价氧化物对应的水化物的碱性是短周期中碱性最强的,则:
(1)A的气态氢化物的电子式为 B离子的离子结构示意图为
(2)D的最高价氧化物对应的水化物的化学式为,含有键和
键。
(3)C单质的结构式。
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,C是家庭中常用的一种调味品的主要成分,D是具有果香气味的物质。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
(1)A、B、C中含有的官能团分别是,,(写名称)
(2)写出反应的化学方程式
A→B:
反应类型:
B+C→D:
反应类型:
(3)B在Cu作催化剂的情况下可催化氧化,其方程式为
(1)某烷烃含有200个氢原子,那么该饱和烃的分子式是。
(2)辛烷的分子式为。
(3)A~D是几种烃分子的球棍模型,据此回答下列问题: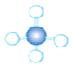
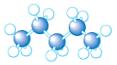
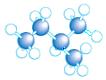
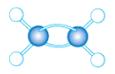
A B C D
则:C的结构简式为。与B、C互为同分异构体的另一有机物的结构简式为
(共11分)如图为某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略。)
按图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气……
(1)这三步操作的先后顺序依次是 。
(2)简要说明排空气的方法和证明空气已排尽的方法 。
(3)B装置所起的作用是 。
(4)若对E装置中的混和物再按以下流程实验:
①分离操作I、II的方法是:I ,II 。
②Na2SO3溶液的作用是(用离子方程式表示)
。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了1.82g,G装置中固体质量减少了4.16g,则丁烷的裂解产物中:n(CH4):n(C2H6)=