(1)某烷烃含有200个氢原子,那么该饱和烃的分子式是 。
(2)辛烷的分子式为 。
(3)A~D是几种烃分子的球棍模型,据此回答下列问题: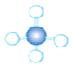
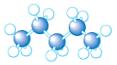
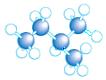
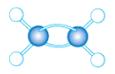
A B C D
则:C的结构简式为 。与B、C互为同分异构体的另一有机物的结构简式为
(15)用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________(从下列中选用
A.10 mL B.25 mL C.50 mL D.1 00 mL)。
00 mL)。
(2)第③步实验的操作是________________________________(具体操作方法)。
(3)第⑤步实验的操作是________________________________(具体操作方法)。
(4)第④步实验操作的目的是________________________________。
(5)溶液转 移到容量瓶之前需要恢复到室温是因为_______________________________
移到容量瓶之前需要恢复到室温是因为_______________________________ _。
_。
(6)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)A.所用的浓硫酸长时间放置在密封不好的容器中________________________________
B.容量瓶用蒸馏洗涤后残留有少量的水________________
C.所用过的烧杯、玻璃棒未洗涤________________
D.定容时俯视刻度线________________
E .定容时加蒸馏水不慎超过了刻度_______________
.定容时加蒸馏水不慎超过了刻度_______________
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。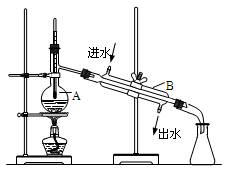
(1)图中有两处明显的错误是
①;②。
(2)A仪器的名称是,B仪器的名称是。
(3)实验时A中除加入少量自来水外,还需要加入少量的,其作用是。
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下: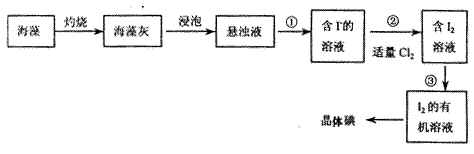
(1)指出提取的过程中有关实验操作名称:① ;③。
;③。
(2)提取碘的过程中,可供选择的有机溶剂是。
A. 水、酒精 B. 四氯化碳、苯 C. 汽油、酒精
(12分)根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么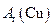 (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H20),由此计算 。为此,提供的实验仪器及试剂如下(根据需要
。为此,提供的实验仪器及试剂如下(根据需要 可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):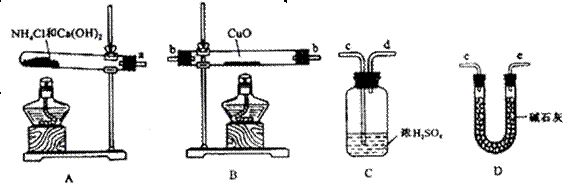
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)=" a" g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
① CuO未完全起反应② CuO不干燥
③ CuO中混有不反应的杂质④碱石灰不干燥
⑤ NH4C1与Ca(OH)2混合物不干燥
NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或_______________和_______________达到实验目的。
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定 管并使滴定管尖嘴充满液体
管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”)_______________ ___
___
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影 响”)___________________
响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)图19是某次滴定时的滴定管中的液面,其读数为 mL
(5)根据下列数据:请计算待测盐酸溶液的浓度:mol/L
| 滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |