(共11分)如图为某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略。)
按图连接好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气……
(1)这三步操作的先后顺序依次是 。
(2)简要说明排空气的方法和证明空气已排尽的方法 。
(3)B装置所起的作用是 。
(4)若对E装置中的混和物再按以下流程实验:
①分离操作I、II的方法是:I ,II 。
②Na2SO3溶液的作用是(用离子方程式表示)
。
(5)假定丁烷完全裂解,流经各装置中的气体能完全反应。当(E和F)装置的总质量比反应前增加了1.82g,G装置中固体质量减少了4.16g,则丁烷的裂解产物中:n(CH4):n(C2H6)=
某课外学习小组在学习了Na2O2与CO2的反应后,认为Na2O2与SO2应该也可以反应。他们设计了下图装置(夹持装置已略去,装置的气密性良好)进行实验,探究SO2与Na2O2反应的产物,请按要求回答下列问题。
Ⅰ﹒写出装置A中发生反应的化学方程式:___________________________
Ⅱ﹒装置D的作用:除了可以防止空气中的CO2、水蒸气等进入C中与Na2O2反应,还可以_____________
Ⅲ﹒在通入足量的SO2与Na2O2充分反应后,他们对C中固体产物提出如下假设:
假设1:只有Na2SO3;
假设2:_________;
假设3:既有Na2SO3,又有Na2SO4。
(1)若假设1成立,写出SO2与Na2O2反应的化学方程式:________________
(2)为进一步确定C中反应后固体产物的成分(Na2O2已反应完全),甲同学设计了如下实验:
甲同学由此得出结论:产物是Na2SO4,该方案是否合理______(填“是”或“否”),理由是_____________
(3)乙同学设计了如下实验验证假设3成立,请帮助他完成下表。
| 实验步骤 |
现象 |
| ①取少量C中固体产物于试管中,加入适量的蒸馏水溶解。 |
固体全部溶解 |
| ②向上试管中加入过量的_____________,将产生的气体通入少量酸性KMnO4溶液中。 |
KMnO4溶液__________ |
| ③向步骤②反应后的试管中,加入适量的BaCl2溶液。 |
产生白色沉淀 |
步骤②中将产生的气体通入少量酸性KMnO4溶液中,发生反应的离子方程式为:__________
某化学兴趣小组利用如下图装置验证元素非金属性的变化规律。
(1)仪器A的名称为________,干燥管D的作用是________。
(2)实验室中现有药品KMnO4、MnO2、浓盐酸、Na2S,请选择合适药品设计实验验证非金属性:Cl>S,装置A、B、C中所装药品应分别为浓盐酸、________、Na2S溶液,装置C中的实验现象为有淡黄色沉淀生成,装置C中发生反应的离子方程式为____________。
(3)若利用上装置证明非金属性:S>C>Si。在A中加入稀硫酸、B中加入Na2CO3溶液、C中加入Na2SiO3溶液,观察到B中产生气泡,试管C中出现________现象,则可以证明非金属性:S>C>Si。
若将A中的稀硫酸改为稀盐酸,试管C中会出现同样的现象,是否可以得出结论:非金属性Cl>C>Si?__________(填“是”或“否”),你的理由是______________________。
为确定某酸HA是弱电解质,两同学的实验方案如下:
甲:①称取一定质量的HA,配制0.1 mol·L-1的溶液100 mL;
②用pH计测出该溶液的pH,根据pH="-lg" c(H+),推算出溶液中H+的浓度,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制0.1mol·L-1的两种酸溶液各100 mL;
②分别取配制的这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是______。
(2)甲方案中说明HA是弱电解质的理由是测得溶液的H+的浓度__0.1 mol·L-1(选填“>”、“<”或“=”)。
(3)乙方案中说明HA是弱电解质的现象是___。
A.装盐酸的试管中放出气体的速率快;
B.装HA溶液的试管中放出气体的速率快;
C.两个试管中产生气体的速率一样快。
(4)请你评价:乙方案中的不妥之处:_________________________________。
(5)已知在T°C时,0.1 mol·L-1HA溶液中HA的电离度为5%,求该温度下HA的电离常数(写出计算过程)
某学生实验小组,用稀硫酸和稀氢氧化钠溶液在下图所示的装置中,进行中和反应反应热的测定。请回答下列问题:
(1)图中装置缺少一种仪器,该仪器名称为__。
(2)写出该反应的热化学方程式(中和热为57.3kJ·mol-1):__________________。
(3)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值将__________(填“偏大”、“偏小”或“无影响”)。
实验室用下图装置制取少量溴苯,试填写下列空白。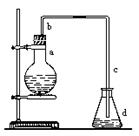
(1)在烧瓶a中装的试剂是铁粉、和。(各1分)
(2)请你推测长直导管b的作用:__________
(3)请你分析导管c的下口可否浸没于液面中?为什么? __________
(4)反应完毕后,向锥形瓶d中滴加AgNO3溶液有生成,此现象说明这种获得溴苯的反应属于:。(填有机反应类型)(各1分)