(12分)某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如
下几步:
A 移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B 用标准溶液润洗滴定管2-3次
C 把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面刻度
(1) 正确操作的顺序是(用序号字母填写) B- 。
(2) 滴定开始后,眼睛注视 ,判断滴定终点的现象是:
(3) 下列操作中可能使所测盐酸的浓度数值偏高的是
A 碱式滴定管未用标准溶液润洗就直接注入标准液
B 滴定前盛放HCl的锥形瓶用蒸馏水洗净后有少量水残留
C 碱式滴定管在滴定前有气泡,滴定后气泡消失
D 读取氢氧化钠溶液时,开始仰视读数,滴定结束时俯视读数
(4)滴定开始和结束时,碱式滴定管中的液面如图C所示,则终点读数为 mL,所测盐酸溶液的浓度为 mol/L。
四只未贴标签的试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,通过下列实验将四种溶液分别检出,请按实验步骤回答下列问题。
在四支试管中分别取四种溶液各1mL,完成下列实验。
(1)在四支试管中分别滴入,出现现象的是,离子反应方程式是 。
。
(2)在剩余三支试管中分别滴入,出现现象的是,离子反应方程式是。
(3)在剩余两支试管中分别滴入 ,出现现象的是, 离子反应方程式是。三次实验中都没有明显现象的是。
,出现现象的是, 离子反应方程式是。三次实验中都没有明显现象的是。
用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释、降温;④转移、洗涤;⑤定容、摇匀。回答下列问题
(1)所需浓硫酸的体积是 ;
;
(2)第⑤步实验的具体操作是 。
。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.容量瓶用蒸馏洗涤后残留有少量的水
B.所用过的烧杯、玻璃棒未洗涤
C.定容时俯视溶液的液面
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
【探究一】设计右图所示装置进行“铁与水反应”的实验。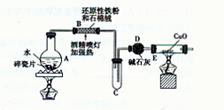
(1)硬质试管中发生反应的化学方程式为。
(2)反应前A中投放碎瓷片的目的是。
(3)装置E中的现象是。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
(4)待硬质试管B冷却后,取少许其中的固体物质溶于后,将所得溶液分成两份。
(5)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)。;若溶液未变红色,推断硬质玻璃管B中固体物质的成分
①一定有Fe3O4,可能有Fe②Fe3O4和Fe③只有Fe3O4④只有Fe
(6)另一份用___(填仪器名称)加入,可以证明溶液中存在Fe2+。
【探究三】设计如下流程利用上述滤液制取绿矾晶体(FeSO4·7H2O)。
滤液 FeSO4溶液
FeSO4溶液 FeSO4·7H2O晶体
FeSO4·7H2O晶体
(7)步骤I中加入洁净废铁屑的作用是(用化学方程式表示)。
(8)步骤II从FeSO4稀溶液中得到FeSO4·7H2O晶体的主要操作包括、趁热过滤____、再过滤。为防止FeSO4变质,该流程中还需注意的问题有。
【探究四】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。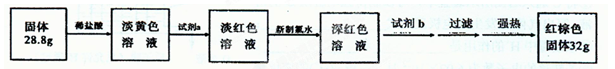
(9)试剂b的化学式是____。
(10)计算反应后B装置中铁元素的质量分数为;根据计算结果判断反应后硬质试管B中固体物质的成分是。
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。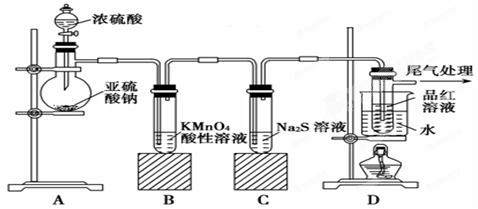
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________。
(2)实验过程中,装置B中产生的现象是________________________,这个现象说明SO2具有的性质是________________。
(3)装置C中Na2S溶液在空气中不易保存,时间长了会变浑浊,原因是(用离子方程式表示) __________________________________。
(4)装 置D的目的是探究SO2与品红作用的可逆性
置D的目的是探究SO2与品红作用的可逆性 ,请写出实验操作及现象_________________________________________________________________________________________________________________。
,请写出实验操作及现象_________________________________________________________________________________________________________________。
(5)如果把分 液漏斗中的中的浓H2SO4换作浓HNO3,对此实验是否有影响
液漏斗中的中的浓H2SO4换作浓HNO3,对此实验是否有影响
________(填“是”或“否” ),请说明你的理由_____________________________
___________________________________________________________。
(6)工业上用黄铜矿( CuFeS2)冶炼铜,副产品中也有SO2 ,冶炼铜的反应为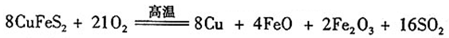
若CuFeS2中 Fe 的化合价为+2 ,反应中被还原的元素是(填元素符号)。当生成0.8 mol铜时,此反应转移的电子数目是___________________。
(10分)在食品加工领域,应用二氧化硫的最主要原因是避免氧化和防腐。在我国葡萄酒中二氧化硫的最大使用量为0.2500g/kg,二氧化硫残留量不得超过0.05000g/kg。葡萄酒中的二氧化硫包括游离的和结合的,因而加人氢氧化钾使之破坏其结合状态,并使之固定S02+2KOH="=" K2S03+H20;然后加入硫酸又使二氧化硫游离,K2S03+H2S04 ="=" K2S04+H2O+S02↑;加入过量的I2氧化S02;过量的I2可用硫代硫酸钠进行滴定,I2+2Na2S203="=" Na2S406+ 2NaI。
以下是某实验小组测定某品牌的干白葡萄酒(密度为1.12g/ml)中二氧化硫的含量是否超标的实验方案。
实验步骤:
①用移液管量取50.00ml样品于250ml锥形瓶中,加入25.00 ml1mol/L氢氧化钾溶液,加塞,摇匀;
②静置15min;
③打开塞子,加入25.00ml1:3硫酸溶液使溶液呈酸性,再加入25.00ml0.01000mol/L碘溶液,迅速的加塞,摇匀;
④用滴定管移取步骤 ③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
⑤重复以上实验2次;
⑥数据处理,得出结论。
请回答下列问题:
(1)以上实验方案中步骤③中加碘溶液时发生的离子反应方程式是:;
(2)步骤①-③中始终要将锥形瓶加塞进行操作的原因是;
(3)步骤④的A溶液最合适的是;滴定终点的判断方法是;
(4)步骤④应该选用(填空“酸式”或“碱式”)滴定管;
(5)该小组三次实验消耗的Na2S203溶液的体积数据记录如下:
| 序号 |
滴定前/mL |
滴定后/mL |
| ① |
1.35 |
19.40 |
| ② |
1.05 |
19.00 |
| ③ |
1.58 |
20. 91 91 |
根据数据计算该样品中总二氧化硫的浓度为mol/L,故该干白葡萄酒是(填“合格”“不合格”)产品。