(10分)在食品加工领域,应用二氧化硫的最主要原因是避免氧化和防腐。在我国葡萄酒中二氧化硫的最大使用量为0.2500g/kg,二氧化硫残留量不得超过0.05000g/kg。葡萄酒中的二氧化硫包括游离的和结合的,因而加人氢氧化钾使之破坏其结合状态,并使之固定S02+2KOH ="=" K2S03+H20;然后加入硫酸又使二氧化硫游离,K2S03+H2S04 ="=" K2S04+H2O+S02↑;加入过量的I2氧化S02;过量的I2可用硫代硫酸钠进行滴定,I2+2Na2S203="=" Na2S406+ 2NaI。
以下是某实验小组测定某品牌的干白葡萄酒(密度为1.12g/ml)中二氧化硫的含量是否超标的实验方案。
实验步骤:
①用移液管量取50.00ml样品于250ml锥形瓶中,加入25.00 ml1mol/L氢氧化钾溶液,加塞,摇匀;
②静置15min;
③打开塞子,加入25.00ml1:3硫酸溶液使溶液呈酸性,再加入25.00ml0.01000mol/L碘溶液,迅速的加塞,摇匀;
④用 滴定管移取步骤 ③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
⑤重复以上实验2次;
⑥数据处理,得出结论。
请回答下列问题:
(1)以上实验方案中步骤③中加碘溶液时发生的离子反应方程式是: ;
(2)步骤①-③中始终要将锥形瓶加塞进行操作的原因是 ;
(3)步骤④的A溶液最合适的是 ;滴定终点的判断方法是 ;
(4)步骤④应该选用 (填空“酸式”或“碱式”)滴定管;
(5)该小组三次实验消耗的Na2S203溶液的体积数据记录如下:
| 序号 |
滴定前/mL |
滴定后/mL |
| ① |
1.35 |
19.40 |
| ② |
1.05 |
19.00 |
| ③ |
1.58 |
20. 91 91 |
根据数据计算该样品中总二氧化硫的浓度为 mol/L,故该干白葡萄酒是 (填“合格”“不合格”)产品。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题: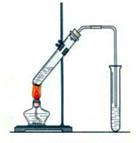
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的顺序是:先加再加和。
(2)浓硫酸的作用是:①;②。
(3)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(4)饱和碳酸钠溶液的主要作用是①②
③。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(8)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是_________________。
(10分)下图是化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图。 ,
,
(1)B中逸出的主要气体是____________________(填名称);
(2)D瓶的作用是_____________________________;
(3)E管的作用是_________________________;
(4)F管口点燃的气体是___________________(填化学式);
(5)A瓶中无水 变蓝的原因是________________________。
变蓝的原因是________________________。
(6)由A中发生的反应事实可推断出的结论是:________________________
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;目的是____________________;当试管A内的主要反应完成后温度计水银球的位置应在___________________,目的是_____________________________;
(3)烧杯B的作用是___________________________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、碳酸氢钠粉末。实验仪器任选。该方案为______________________________。
(12分)某同学为了探究锌与硫酸反应过程中的速率变化,他在100mL稀硫酸中加入足量的锌粉,标况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL)(标准状况) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大______________,原因是______________________________________________。
(2)哪一时间段的反应速率最小________________,原因是___________________。
(3)求2~3分钟时间段以硫酸的浓度变化来表示的该反应速率(设溶液体积不变,要写出计算过程)______________________________________________________。
(4)该同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
①上述实验中涉及到的离子反应方程式有
;
②硫酸铜溶液可以加快氢气生成速率的原因是;
③实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是;
④该同学通过实验进一步研究了硫酸铜的量对氢气生成速率的影响。该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
。
如图所示装置,在化学实验中十分常见,它可以作为制取气体、收集气体、性质验证、安全防护等多种作用,按要求回答相关问题:
(1)干燥CO2气体时,广口瓶中可装入的试剂1是______________。
(2)除掉CO中混有的CO2,可以在广口瓶中盛装试剂2溶液。
(3)用此装置可以用排气法收集CO2气体,应从导管口进出。(填a或b)
如果用此装置收集CO气体,应怎样操作,简述操作方法:
_________________________________________________________________________。
(4)广口瓶C中盛有BaCl2溶液,如果从b端通入CO2气体,甲同学说有沉淀生成,乙同学说没有沉淀出现。根据你所掌握的知识,判断其正确性,选择你同意的一方意见回答相关问题(两项全答计0分)。
I.我同意甲同学意见,得到的沉淀物质化学式为__________________。
II.我同意乙同学意见,如要出现沉淀,可以预先在广口瓶中加入一些试剂3,再通入CO2气体,立即会出现沉淀,则试剂3可以是_____________(填试剂名称或化学式)。