中和滴定是化学定量实验之一。某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
(1)在中和滴定的过程中有如下操作:①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤,则在操作过程中正确的顺序是__________________。(写序号)
(2)选用的指示剂是 。(a、石蕊 b、甲基橙)
(3)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(4)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,请将数据填入下面表格的空白处。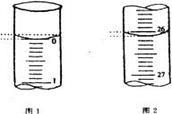
| 滴定次数 |
待测氢氧化钠溶液的体积/ mL |
0.1000 mol/L 盐酸的体积/ mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/ mL |
||
| 第一次 |
25.00 |
|
|
|
| 第二次 |
25.00 |
2.00 |
28.08 |
26.08 |
| 第三次 |
25.00 |
0.22 |
26.34 |
26.12 |
(6)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= 。
(7)滴定终点的判定依据是 。
[2012·课标全国卷]溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下: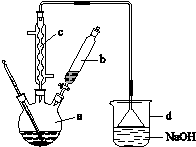
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 水中溶解度 |
微溶 |
微溶 |
微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是____________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是______________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
[2012·东北哈师大附中、东北师大附中、辽宁省实验中学第二次联合模拟]某同学为了探究铜与浓硫酸的反应,进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。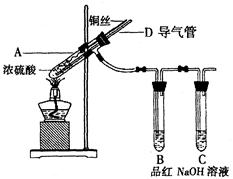
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将铜丝向上提至离开液面。
(1)装置A中发生反应的化学方程式为。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操是。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下图的实验: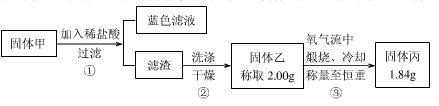
(4)②中检验滤渣是否洗涤干净的实验方法是。
(5)③中在煅烧过程中一定发生的反应的化学方程式为。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项)。
| A.固体甲中,CuS和Cu2S不能同时存在 |
| B.固体甲中,CuO和Cu2O至少有一种 |
| C.固体甲中若没有Cu2O,则一定有Cu2S |
| D.固体甲中可能有Cu2S |
[2012·山东莱芜二模]为探究氨的制取和性质,某兴趣小组的同学进行了如下实验。实验室制取氨气可以将浓氨水滴入生石灰中。装置如图所示。
(1)A中发生反应的化学方程式为;
(2)若要在C中收集满一瓶干燥的氨气,请在C装置中的虚线上描出导管实线图,B中应装入的试剂是;
(3)为吸收处理多余的氨气,可选择D、E、F装置中的装置;
(4)为探究氨气的还原性,他们往C装置中通入干燥氯气与氨气反应。
①若用二氧化锰与浓盐酸加热制取氯气,为得到干燥纯净的氯气,反应产生的氯气必须依次通过盛有试剂的洗气瓶;
②C中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,反应的化学方程式为;
③设计实验,检验C中生成的白烟中的阳离子。
[2012·广东肇庆市一模]I:某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为;
C中反应的离子方程式为。
(2)为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是(写两点)。
II:用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。请回答:
(3)氨水吸收过量SO2的反应的离子方程式为。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 |
预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 |
若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 |
。 |
| 步骤3: 。 |
。 |
[2012·德州一模]有色金属冶炼厂剩下的废料中,含有金、银、铂、钯等贵重金属,为提高经济效益,某科技小组要从废料中提取金、银、铂、钯等贵重金属,步骤设计如下图甲,试回答下列问题:
(1)实验步骤中,浓硫酸浸煮产生尾气的主要成分是(填化学式),常用足量NaOH溶液进行尾气处理,发生反应的离子方程式为。
(2)在实验室中操作I中需要的玻璃仪器有。
(3)实验过程中所需的氯气在制备中,会混有杂质(H2O和HCl),科技小组设计了图乙所示的实验装置,证明水蒸气和HCl杂质的存在,请根据设计示意图完成下列有关问题:
①A是氯气发生装置,其中发生的离子方程式为。
②实验装置的接口顺序为:b接,接,接a。
③装置D的作用是。
④在实验中,一组员认为该实验设计存在缺陷:不能证明最终通入AgNO3溶液的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,他们提出在某两个装置之间再加装置E。如右图所示。你认为装置E应加在之间(填装置字母序号),并且在广口瓶中放入(填写所有试剂或用品名称)。