化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。
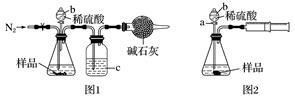
(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的__________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是__________,洗气瓶c中盛装的是 。实验开始前,打开止水夹,先通入N2,,通入N2的作用是_______________________________;一会后,连接上干燥管,打开b的活塞,滴下稀硫酸,充分反应后,再通入N2的目的 。
(2)乙同学用图2所示装置,取一定质量的样品(m g)和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的__________,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的______(填“体积”或“质量”)。
(3)丙同学用下图所示方法和步骤进行实验:
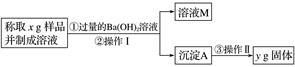
①操作Ⅰ涉及的实验名称有__________、洗涤;操作Ⅱ涉及的实验名称有干燥、__________。
②丙同学测得的样品中Na2CO3质量分数的计算式为__________。
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下: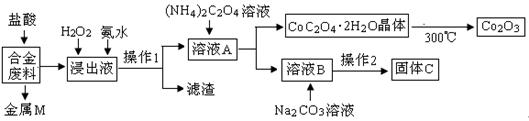
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)充分焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 ,90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。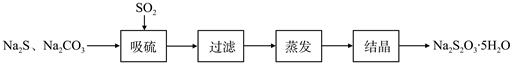
(1)吸硫装置如图所示。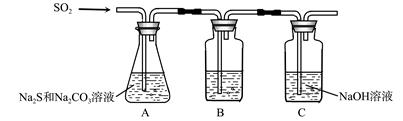
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是 ,表明SO2吸收效率低的实验现象是B中溶液 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 、 。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=10.2)
限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 |
实验操作 |
预期现象 |
结论 |
| ① |
取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,___________________。 |
_______________ |
样品含NaCl |
| ② |
另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,___________________。 |
_______________ |
样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取a g KIO3固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=_________mol·L-1。(只列出算式,不作运算)
已知:IO3-+5I-+6H+==3I2+3H2O 2S2O32-+I2==S4O62-+2I-
下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。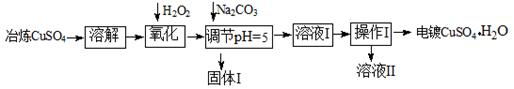
已知:①Fe3+ Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为① 。
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为______________。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式 。
研究性学习小组利用下列有关装置进行探究实验,回答相关问题。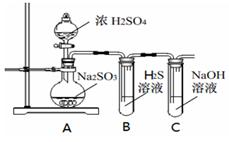
(1)写出A中的反应化学方程式 。
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是 。
(3)装置B中的溶液出现浑浊,该实验证明SO2具有 性 。
(4)实验后,测定装置C中溶液呈碱性。溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种意见成立。选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 |
实验操作 |
预期现象与结论 |
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室含SO2的空气,当溶液刚好褪色,停止实验。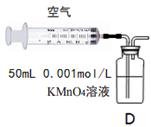
该小组的实验目的是 。
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: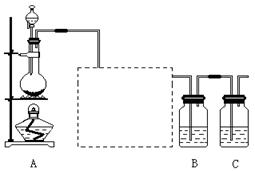
(1)装置A的分液漏斗中盛装的试剂是,烧瓶中加入的试剂是。
(2)虚线框内的实验装置的作用。
(3)装置B中盛放的试剂是(选填下列所给试剂的代码),实验现象为,化学反应方程式是,该反应属于四种基本反应类型中的反应。
A.Na2S溶液B.Na2SO3溶液C.Na2SO4溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。