研究性学习小组利用下列有关装置进行探究实验,回答相关问题。
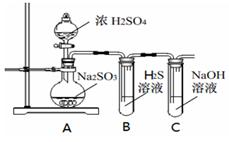
(1)写出A中的反应化学方程式 。
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是 。
(3)装置B中的溶液出现浑浊,该实验证明SO2具有 性 。
(4)实验后,测定装置C中溶液呈碱性。溶液为什么呈碱性呢?大家有不同意见:①是生成的Na2SO3水解;②是氢氧化钠剩余。请设计实验方案证明哪种意见成立。选用下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 |
实验操作 |
预期现象与结论 |
| |
|
|
(5)另一小组利用装置D进行实验:用注射器向装置D共注入v mL实验室含SO2的空气,当溶液刚好褪色,停止实验。
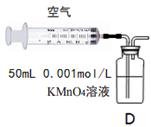
该小组的实验目的是 。
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是;
(2)装置E中的现象是。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。将滤液分成两份,分别检验滤液中的金属阳离子。检验Fe3+所用试剂为,检验Fe2+所用试剂为。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下: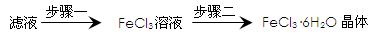
①步骤一中通入足量Cl2发生反应的离子方程式为。
②步骤二从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作如下(均在HCl气氛中进行):
蒸发、浓缩 → 冷却、结晶 → 过滤、洗涤、干燥
在蒸发皿中进行蒸发浓缩操作时,当_________________________时,应停止加热。此过程应保持盐酸过量的原因________________________________________(用离子方程式表示)。
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先除去其中的空气。其中第一步实验操作为: ___________。如何确定E中空气已被赶尽: ____________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子反应方程式为 。
(3)如何证明E中收集到的是NO而不是H2?。
一段时间后,C中白色沉淀溶解,其原因是__________________________ 。
。
(4)装置D的作用是__________________________________________________。
图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。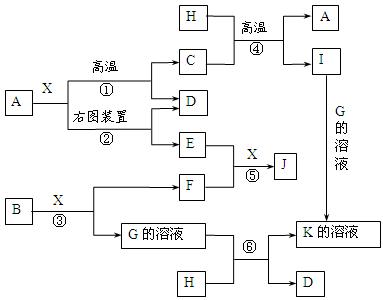
请 按要求填空:
按要求填空:
⑴写出B的化学式:。
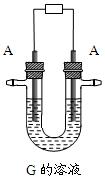
⑵写出用A作电极电解G溶液,在电极上生成E的反应式:,反应⑤的现象是。
⑶反应①的化学方程式是,
反应④在生产中有重要应用,被称为反应。
⑷反应⑥的离子方程式是。
用脱脂棉包住0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来。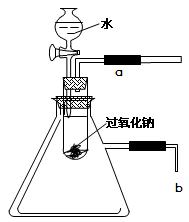
(1)由上述实验现象可得出两条有关过氧化钠跟水反应的结论是:
第一:;第二: 。
(2)某研究性学习小组拟用如下图所示的装置进行实验,
以验证上述结论。
用以验证第一条结论的实验操作是 现象是 。
为了验证第二条结论,将管口b浸入水中,可观察到的现象为 。
(12分) 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
⑴图中有两处明显的错误是:①;②。
⑵ A仪器的名称是,B仪器的名称是。
⑶实验时A中除加入少量自来水外,还需要加入少量的,其作用是。