Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞溶液变红是因为__________,红色褪去的可能原因是__________________。
②加入MnO2反应的化学方程式为________________________________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。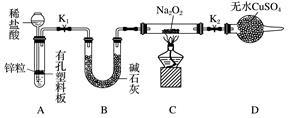
步骤1:按上图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是____________;B装置的作用是________。
②必须检验氢气纯度的原因是__________________________________________________。
③设置装置D的目的是________________________________________________________。
④你得到的结论是____________(若能反应请用化学方程式表示)。
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)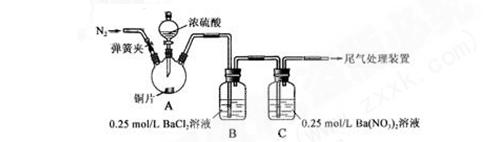
实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 |
___________________ |
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
尚 未发现白色沉淀溶解 未发现白色沉淀溶解 |
(1)A 中反应的化学方程式是_________________。
(2)C中白色沉淀是__________________,该沉淀的生成表明SO2具有___________性。
(3)C中液面上方生成浅棕色气体的化学方程式是_____________________。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气中成分共同作用,乙认为是只有白雾参与反 应。
应。 ①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是_____________;
乙在A、B间增加洗气瓶D,D中盛放的试剂是_____________。
②进行实验,B中现象:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶 于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
于稀盐酸。结合离子方程式解释实验现象异同的原因:_____。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____________。
为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是▲
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认 为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选
为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选 用▲ (选填序号)。
用▲ (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O===2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为▲。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。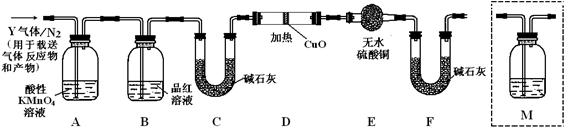
(3)装置B中试剂的作用是▲
(4)分析Y气体中的Q2气体是如何生成的▲(用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于▲(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是▲
某同学用下面装置实现铜与浓、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅲ.按下图所示连接仪器、检查气密性、装入化学试剂。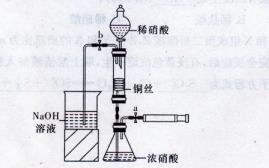
(1)过程I发生反应的离子方程式是______________________。
(2)过程Ⅱ将铜丝做成螺旋状的目的是______________________。
(3)过程Ⅲ的后续操作如下:
①为使浓硝酸与铜丝接触.操作是______________________。当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器。
②换入另一注射器后,打开b和分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见无色气体产生。稀硝酸充满玻璃管的实验目的是______________________。
(4)已知:NO+NO2+2NaOH2NaNO2+H2O;2NO2+2NaOHNaNO3+NaNO2+H2O,NO和NO2的混合气体的组成可表示为NOx。将该混合气体通人NaOH溶液被完全吸收时,x的取值范围应为______________。
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: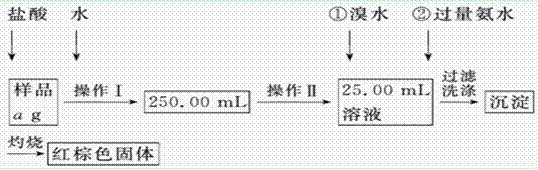
请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称),操作Ⅱ必须用到的仪器是________(填编号)。
| A.50 mL烧杯 | B.50 mL量筒 | C.100 mL量筒 | D.25 mL滴定管 |
(2)请写出加入溴水发 生的离子反应方程式
生的离子反应方程式 ________________________,加入氨水要过量的原因是___________________________。
________________________,加入氨水要过量的原因是___________________________。
(3)检验沉淀是否已经洗涤干净的操作是___________ _
_ _________________
_________________
___________ _______________________________________________。
_______________________________________________。
(4)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是______________ (列出原始计算式,不需化简);若称 量准确,最终测量的结果偏大,则造成误差的原因可能是___________________________
量准确,最终测量的结果偏大,则造成误差的原因可能是___________________________
________________________________。(写出一种原因即可)。
某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置。请回答下列问题: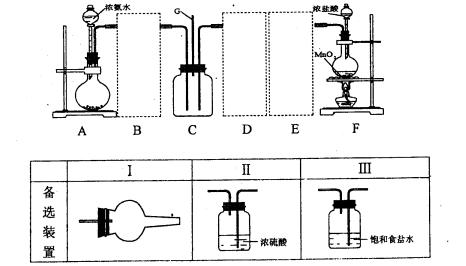
(1)装置A中烧瓶内的固体可选用。
a.烧碱b.生石灰. c.二氧化硅 d.五氧化二磷
(2)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格。B;D;E(填编号)。装置I中需要的试剂是。
(3)写出F中发生反应的离子方程式:。
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子的操作步骤:。
(5)该装置连接后尚存在的缺陷是:。