某同学用下面装置实现铜与浓、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅲ.按下图所示连接仪器、检查气密性、装入化学试剂。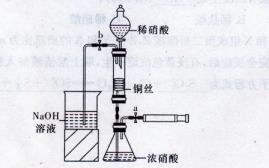
(1)过程I发生反应的离子方程式是______________________。
(2)过程Ⅱ将铜丝做成螺旋状的目的是______________________。
(3)过程Ⅲ的后续操作如下:
①为使浓硝酸与铜丝接触.操作是______________________。当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器。
②换入另一注射器后,打开b和分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见无色气体产生。稀硝酸充满玻璃管的实验目的是______________________。
(4)已知:NO+NO2+2NaOH 2NaNO2+H2O;2NO2+2NaOH NaNO3+NaNO2+H2O,NO和NO2的混合气体的组成可表示为NOx。将该混合气体通人NaOH溶液被完全吸收时,x的取值范围应为______________。
(11分)某同学按下列步骤配制500 mL 0.2 mol·L-1 KCl溶液,请回答下列问题:
| 实验步骤 |
有关问题 |
| (1)计算所需KCl的质量 |
需要KCl的质量为______g |
| (2)称量KCl固体 |
称量过程中主要用到的仪器有________________ |
| (3)将KCl放入到100 mL烧杯中加水溶解 |
为加快溶解速度,可采取的措施是______________________ |
| (4)将烧杯中的溶液转移至500 mL容量瓶中 |
为防止溶液溅出,应采取的措施是____________________ |
| (5)向容量瓶中加蒸馏水到刻度线 |
在进行此操作时应注意的问题是__________________________ |
你认为按上述步骤配制的KCl溶液的浓度是否为0.2 mol·L-1,请说明理由。
(12分)一小块钠露置在空气中,可观察到如下现象(a~f代表对应的物质):
试回答以下问题:
(1)以上变化属于物理变化的是______(从①②③④⑤中选择填写),这一现象在化学上称之为______。
(2)两种或两种以上的反应物生成一种生成物的反应叫化合反应。以上化学变化属于化合反应的是______。(从①②③④⑤中选择填写)
(3)为证明第④步已发生,如何用实验方法证明。简要叙述实验方法和现象
__________________________________,有关的化学方程式是
__________________________。
(4)若配制500 mL 1 mol·L-1的f溶液,称取53.0 g物质e,则得到的溶液浓度______(大于、小于或等于)1 mol·L-1。所用的玻璃仪器有烧杯、______、______和______。
(12分)下面是某化学研究性学习小组对某水样成分的检验过程,已知该水样中只可能含有K+、Mg2+、Ca2+、Cl-、CO和SO中的若干种,该小组同学取100 mL水样进行实验:
向样品中先滴加BaCl2溶液,再滴加1.0 mol·L-1的盐酸,实验过程中沉淀质量的变化如右图所示:
请回答下列问题:
(1)水样中一定含有的阴离子是________________,其物质的量之比为________。
(2)写出BC段曲线所表示反应的离子方程式________________。
(3)由B点到C点变化过程中消耗盐酸的体积为________。
(4)试根据实验结果推测K+是否存在?________(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是________。(若K+不存在,则不必回答该问)
(12分)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3―→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平,不考虑2NO2N2O4)。
(1)硝酸在该反应中体现的性质是________。
(2)0.004 mol Cu被硝酸完全溶解后,Cu失去的电子数是________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是________,在标准状况下若将收集NO和NO2的集气瓶倒立于水中,通入一定量的氧气充分反应后发现无气体剩余,则通入O2的体积为________;所得溶液(假设溶质不扩散)的物质的量浓度是________。
(3)如果参加反应的Cu和HNO3的物质的量之比是3∶10,写出并配平该反应的离子方程式______________________________________。
(4)如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是____________________________________。
(10分)中学化学中几种常见物质的转化关系如下:(提示:A单质有可变价态且与硫反应生成低价态)
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体F粒子直径大小的范围:________。
(2)B的化学式:________。
(3)写出:D的溶液与氨水反应的离子方程式:
________________________________________________________________________;
C的溶液与双氧水反应的离子方程式:
________________________________________________________________________。
(4)写出鉴定E中阳离子的实验方法和现象:
________________________________________________________________________。