某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_ .
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 .
(3)实验①和②的目的是__________________________________________.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图.
分析上图能够得出的实验结论是 .
(6分)右图所示装置有多种用途,请回答下列问题: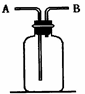
(1)检验:证明CO中混有CO2,装置内应盛
(2)集气:若用排空气法收集比空气轻的气体时,气体应从装置的端通入(填A或B,下同);若收集比空气重的气体,则气体从端通入。
(10分)欲用含有少量氯化钙的氯化钠固体,配制100 mL 1mol/L的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题: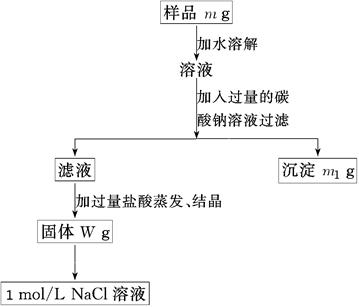
⑴称量粗盐样品m g,样品放在托盘天平左盘上。
⑵过滤时,需用到的玻璃仪器除烧杯、玻璃棒外有。
⑶蒸发操作时应将液体放在______中加热,等加热至________时即停止加热。
⑷在样品的溶液中加入过量的Na2CO3溶液,作用是____________________________,反应的离子方程式是______________________。
⑸在滤液中加入盐酸的作用是________________,发生反应的化学方程式是___________。
⑹配制100 mL 1mol/L的NaCl溶液时,应从W g固体中称取NaCl的质量为____________。
实验室配制500ml 2mol·L-1的H2SO4溶液
(1)500ml 2mol·L-1的H2SO4溶液中所含溶质的质量是g。
(2)配制时,所需仪器应该有烧杯、玻璃棒、量筒、、。
(3)容量瓶在使用前,首先应检查。
(4)此实验中,玻璃棒的两个作用分别是、。
(5)下列操作会使配制的溶液浓度偏低的是(选填序号)
| A.没有将洗涤液转移到容量瓶 | B.定容时俯视刻度线 |
| C.容量瓶洗净后未干燥 | D.转移过程中有少量溶液测出 |
(12分)下图为苯和溴取代反应的改进实验装置。其中A为带支管的试管改制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑。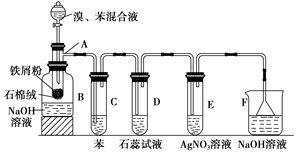
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):_______________________________________。
(2)试管C中苯的作用是________________________________________________;
反应开始后,观察D试管,看到的现象为______________________________________。
(3)在上述整套装置中,具有防倒吸作用的仪器有_________________________(填字母)。
(4)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是____________________________________________。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯

(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是_________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_______层(填上或下),分液后用_______ (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C. Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入,目的是__________________。
③收集产品时,控制的温度应在左右。以下区分环己烯精品和粗品的方法,合理的是_________。
A用酸性高锰酸钾溶液 B用金属钠 C测定沸点