碳酸钙和硫酸钙都是钙的重要化合物,它们在生产生活中都有着广泛的应用。甲、乙两组同学分别对碳酸钙的制备、硫酸钙的性质进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如下: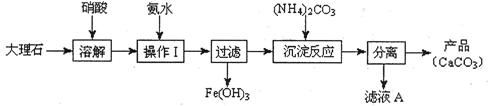
①溶解大理石时,用硝酸而不用硫酸的原因是 。
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、 、 。
③“滤液A”中除H+离子外,还含有的阳离子是 ;检验该阳离子的实验方法是:取少量滤液A与 在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察现象即可。
(2)乙组对某硫酸钙晶体(xCaS04·yH20)加热分解的有关反应进行探究。他们取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如下图所示。又知t5~t6时间段内固体质量减轻的原因是产生了两种气体,反应的化学方程式为:
2CasO4  2CaO+2S02↑+O2↑。
2CaO+2S02↑+O2↑。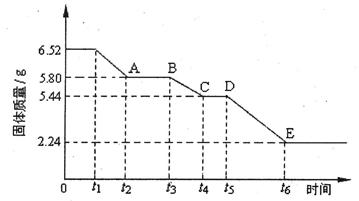
①加热时,该晶体开始发生化学变化的时间是 (填“t1”、“t3”或“t5”)。
②t4~t5时间段固体的化学式为 。
③tl~t2时间段固体发生反应的化学方程式为 。
实验探究:探究碳、硅元素的非金属性的相对强弱
根据要求完成下列各小题
(1)实验装置:
填写所示仪器名称AB
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是;
装置E中足量酸性KMnO4溶液的作用是;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
(一)制取氧化铜
①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
⑴上述实验步骤中需要使用玻璃棒的是_______________(填实验序号)
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用右下图装置进行实验,实验时均以生成25 mL气体为准,其它可能影响实验的因素均已忽略,相关数据如下:
| 实验序号 |
KClO3质量 |
其它物质质量 |
待测数据 |
| ④ |
1.2 g |
无其他物质 |
|
| ⑤ |
1.2 g |
CuO 0.5 g |
|
| ⑥ |
1.2 g |
MnO2 0.5 g |
回答下列问题: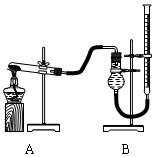
⑵上述实验中的“待测数据”指;
⑶若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,;
⑷为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.,
b.CuO的化学性质有没有改变。
H2O2是实验室常用的一种化学试剂。某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)实验①和②的目的是_ ,
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是。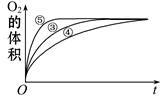
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是。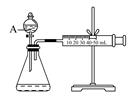
(4)H2O2能氧化H2SO4酸化的FeSO4,离子方程式为;
某学生用0.1mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:A.移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)____________。
(2)判断到达滴定终点的实验现象是:_________________。
(3)操作步骤B的意义:。
(4)下面a~e是中学化学实验中常见的几种定量仪器:a 量筒;b 容量瓶;c 滴定管;d 托盘天平;e 温度计
①.其中标示出仪器使用温度的是________________(填写编号);
②.由于错误操作,使得到的数据比正确数据偏小的是_____________(填写编号);
A.用量筒量取一定量液体时,俯视液面读数
B.中和滴定达终点时俯视滴定管内液面度数
C.使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
D.用待测溶液润洗锥形瓶
实验是化学研究的一种重要手段,现有下图所示A~G七种仪器,请根据要求填空。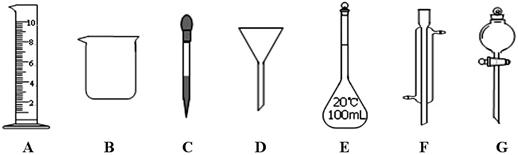
(1)写出仪器名称:B,F
(2)下列实验操作中用到仪器G的是(选填下列选项的编号字母)。
a.分离水和CC14的混合物 b.分离水和酒精的混合物 c.分离水和泥砂的混合物
(3)实验室配制100mL 0.5mol/L的盐酸溶液。
①下列关于仪器E的使用方法中,正确的是(选填下列选项的编号字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到容量瓶中
②需10mol/L的浓盐酸mL。取用该体积盐酸时,需要用到上述仪器中的A和
(选填仪器的编号字母)。
③在实验时,按下列步骤“计算→量取→溶解→转移→定容→保存到试剂瓶中”进行配制,定容后,液面位置(如下左图)正确的是(选填下列选项的编号字母)。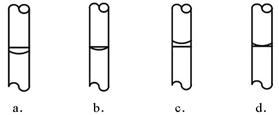
④请在试剂瓶标签上填写相应内容(盛放上述配制好的溶液)[(标签如上右图)]。