A为某有机合成的中间体,分子内无支链,在一定条件下发生消去反应可能得到两种互为同分异构体的产物,B是其中的一种,可用于制取合成树脂、染料等多种化工产品。A能发生如下图所示的变化。
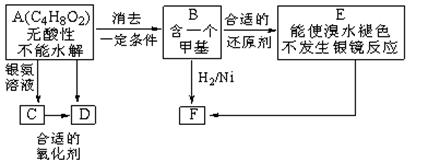
已知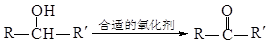 (注:R、R´为烃基)
(注:R、R´为烃基)
试回答:
(1)在A的同分异构体中
a.写出一种具有酸性的结构简式____________________,
b.能发生水解反应的有____________种。
(2) C→D的反应类型是___________,E→F的反应类型是___________。
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(3) D的结构简式是_____________。
(4)写出E生成高聚物的化学方程式:______________。
(5)两分子C脱去两分子水形成含有八元环的M,写出M的结构简式:________________________。
实验室需要配制240mL 1.0 mol·L-1的NaOH溶液。试回答以下有关问题:
(1)该实验中至少需要称取氢氧化钠固体的质量为。
(2)该实验所需要的玻璃仪器,除烧杯、玻璃棒、量筒、胶头滴管外,还需要。
(3)烧碱溶解后未冷却至室温即转移定容,配得的溶液浓度将(填“偏大”、“偏小”或“无影响”,后同);定容时俯视刻度线,配得的溶液浓度将。
(1)造成水体污染的原因是。(填序号)
① 生活污水的任意排放② 工业废水的任意排放
(2)为了治理汽车尾气的污染问题,可以在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成CO2和N2,写出该反应的化学方程式:
_____。
(3)有机合成材料的出现是材料发展史上的一次重大突破。人们常说的三大合成
材料是指、和。
当前环境污染问题越来越严重,如酸雨、温室效应、臭氧层破坏、有毒物质的污染、汽车尾气的污染、水体污染等已成为世界各国普遍关注和研究的问题。
(1)引起温室效应的主要气体是(填序号,下同)。①SO2 ②CO2
(2)能形成酸雨的物质是。①硫的氧化物 ②碳的氧化物 ③氮的氧化物
水体污染的危害是多方面的,它不仅加剧水资源短缺,而且严重危害人体健康。请判断下列说法是否正确(填“√”或“×”)。
 (1)工业废水中含有的酸、碱、盐,会造成水体污染。
(1)工业废水中含有的酸、碱、盐,会造成水体污染。
(2)生活污水中不含工业污染物,因此可以不经处理任意排放。
(3)含重金属(Hg、Pb、Cd、Cr等)的水,对人类健康有害。
(4)含大量N、P的污水任意排向湖泊和近海,会出现水华、赤潮等问题。
下表是某食品包装上的说明,表中列出了部分配料。配料中,富含维生素的是(填序号,下同),属于着色剂的是,属于防腐剂是,属于调味剂的是。
| 品名 |
浓苹果汁 |
| 配料 |
① 浓缩苹果汁 ② 蔗糖 ③ 柠檬黄 ④ 山梨酸钾 |
| 果汁含量 |
≥80% |
| 生产日期 |
标于包装封口处 |