已知:BaSO4(s) + 4C(s) 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
回答下列问题:
(1)不溶物A的化学式是_________;若在实验室进行焙烧时,所产生的气体的处理方法是
a.用NaOH溶液吸收 b.用浓硫酸吸收 c.点燃
(2)用单位体积溶液中所含的溶质质量数来表示的浓度叫质量-体积浓度,可以用g/L表示,现用38%的浓盐酸配制含溶质109.5g/L的稀盐酸500mL,所需要的玻璃仪器除了玻璃棒还有 。
(3)沉淀反应中所加的试剂R可以是下列试剂中的
a.NaOH溶液 b.BaO固体 c.氨水 d.生石灰
证明沉淀已经完全的方法是________________________________________________________。
(4)设计一个实验确定产品氯化钡晶体(BaCl2·nH2O)中的n值,完善下列实验步骤:
①称量样品②_______ ③置于_________(填仪器名称)中冷却 ④称量 ⑤恒重操作。
恒重操作是指____________________________________________ _;
第③步物品之所以放在该仪器中进行实验的原因是 。
(5)将重晶石矿与碳以及氯化钙共同焙烧,可以直接得到氯化钡,该反应的化学方程为
BaSO4+ 4C+CaCl2 4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
(方框内填写操作名称)
(6分)四种短周期元素的微粒信息如下表:
| 元素代号 |
Q |
R |
X |
Z |
| 微粒信息 |
离子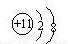 |
单质分子R2 |
离子:X3+ |
一种原子816Z |
已知Q、R、X在同一周期,R2在常温常压下为气态。完成下列填空:
(1)Q位于周期表第----周期----族。化合物Q2Z的电子式为(元素符号表示)
(2)Q、R、X的原子半径由大到小的顺序为。Q、R、X、Z中金属性最强的是(元素符号表示)
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的离子方程式为
(1)用惰性电极电解饱和NaCl溶液,请写出:
① 阳极的电极反应为:;
总反应离子方程式:。
② 要使电解后的溶液恢复到和原溶液一样,则应加入一定量的。
(2)用电解法精炼粗铜,电解液选用CuSO4溶液。请回答:
① 阳极的电极材料是,电极反应式是;
② 阴极电极的材料是,电极反应式是。(杂质发生的电极反应不必写出)
由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式。若1 g水蒸气转化为液态水放热2.444 kJ,则反应H2(g) + 1/2 O2(g) = H2O(l)的△H = kJ·mol-1。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验 编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,用a来说明HA是强酸还是弱酸,若a 7,则HA是强酸;若a7,则HA是弱酸(填<、>、=)。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是。
(3)丙组实验结果分析,HA是酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=mol·L-1。
Ⅰ下列物质属于强电解质的是(填序号)①BaCO3②浓硫酸③Al(OH)3④(NH4)2CO3⑤CH3COOH⑥C6H6⑦SO3⑧CsOH⑨H2S⑩Fe(OH)3
Ⅱ(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质中最理想的是
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的
A. NaOH B. NH3·H2OC. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶1×10-5 mol·L-1度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为,Fe3+完全沉淀时溶液的pH为,通过计算确定上述方案(填“可行”或“不可行”)