关于由 37Cl原子组成的氯气叙述正确的是
| A.71g该氯气样品含1摩尔氯气 |
| B.22.4L该氯气样品质量是74g |
| C.37g该氯气样品与足量NaOH完全反应生成Na37Cl和Na37ClO3,氧化剂和还原剂的质量之比为5:1 |
| D.0.1摩尔氯气分子溶于水形成1000mL溶液,溶液中c(Cl-)+ c(ClO-)=0.1mol/L |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子可能是
| A.Mg2+、Al3+、Fe3+ |
| B.Na+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ |
| D.H+、Mg2+、Al3+ |
有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是
途径① S H2SO4
H2SO4
途径② S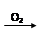 SO2
SO2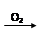 SO3
SO3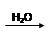 H2SO4
H2SO4
| A.途径①反应中体现了浓HNO3的强氧化性和酸性 |
| B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本 |
| C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e- |
| D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高 |
下列物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是
①铁与稀硝酸②AlCl3溶液与NaOH溶液 ③ 碳酸钠溶液与稀盐酸 ④铁与氯气
| A.全部都是 | B.①②③ | C.②③ | D.③④ |
下列说法正确的是
| A.浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铝钝化 |
| B.浓硫酸与蔗糖混合搅拌产生有刺激性气味的气体,此过程只体现了浓硫酸的脱水性 |
| C.往某溶液中加盐酸产生能使澄清石灰水变浑浊的气体,说明该溶液中一定含CO32-或SO32- |
| D.向某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,不能说明该溶液中一定含SO42- |
大胆、科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的是
| A.探究SO2和Na2O2反应可能有Na2SO4生成 |
| B.探究Na与水的反应可能有O2生成 |
| C.探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS |
| D.探究向滴有酚酞的NaOH溶液通Cl2,褪色原因是溶液的酸碱性改变或HClO的漂白性 |