NO2存在下列平衡:2NO2(g)  N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
| A.温度130℃、压强3.03×105 Pa | B.温度25℃、压强1.01×105 Pa |
| C.温度130℃、压强5.05×104 Pa | D.温度0℃、压强5.05×104 Pa |
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示。下列说法正确的是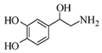
| A.每个去甲肾上腺素分子中含有3个酚羟基 |
| B.每个去甲肾上腺素分子中含有8种氢原子 |
| C.1mol去甲肾上腺素最多能与2molBr2发生取代反应 |
| D.去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
下列反应只能生成一种有机物的是
| A.乙烷与氯气发生取代反应 |
| B.CH3-CH=CH2与HCl发生加成反应 |
C. 发生消去反应 发生消去反应 |
| D.CH3CH2CH2Cl与水发生取代反应 |
有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是
①Fe+Cu2+===Fe2++Cu
②Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
③Cl2+H2O===H++Cl-+HClO
④CO32-+2H+===CO2↑+H2O
⑤Ag++Cl-===AgCl↓
| A.只有③ | B.②③ |
| C.③⑤ | D.①④ |
有关“油”的说法正确的是
| A.油脂包括矿物油、植物油与动物油 |
| B.油脂的氢化与油脂的皂化都属于加成反应 |
| C.植物油能使碘酒褪色 |
| D.油脂属于高分子化合物,可以发生水解反应 |
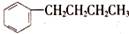 的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)
的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)
| A.7种 | B.6种 | C.5种 | D.4种 |