以烯烃为原料,合成某些高聚物的路线如下: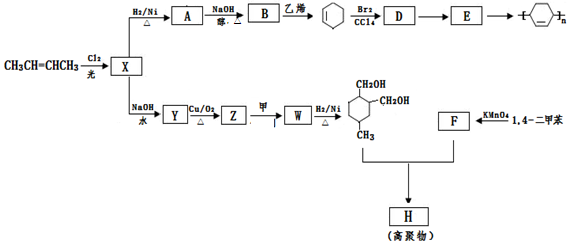
已知:
Ⅰ.
Ⅱ.甲为烃
Ⅲ.F能与NaHCO3反应产生CO2
请完成以下问题:
(1)CH3CH=CHCH3的名称是 , X中官能团的名称是 。
(2)D→E的反应类型为: 。
(3)写出下列化学方程式:
A→B ; E → ;Z→W 。
;Z→W 。
(4)高聚物H的结构简式是 。
某混合物的水溶液中,可能含有以下离子中的若干种:K+、Mg2+、Fe3+、Al3+、Cl-、CO32-和SO42-。现每次取100.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
请回答:
(1)c(CO32-)=______________。
(2)用离子方程式表示该溶液呈碱性的原因:____________________________________。
(3)K+是否存在?_____,(填“是”或“否”)若存在,浓度范围是______________________ (若不存在,则不必回答第(2)问)。
(4)根据以上实验,不能判断哪种离子是否存在?若存在,这种离子如何进行检验?
____________________________________________________________________。
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是__________________。
(2)B、C、D、E 4种物质的化学式为:B_________、C_________、D_________、E_________。
(3)沉淀F与NaOH溶液反应的离子方程式为__________________________________。
沉淀E与稀硫酸反应的离子方程式为__________________________________________。
溶液G与过量稀氨水反应的化学方程式为______________________________________。
在盛有AgNO3、HCl、Na2CO3、CaCl2、NaI五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如右表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“—”表示无现象):
(1)写出③、④、⑤三种物质的化学式为: ③、④、⑤。
(2)写出下列反应的离子方程式:①+②。
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z存在质量数为23,中子数为12的核素 |
| W |
W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)X的电负性比Y的______(填“大”或“小”);
(2)写出W的价电子排布式写出Z2Y2与XY2反应的化学方程式,当1摩尔Z2Y2参加反应时,转移电子的数目:______________。
(3)X、Y的原子可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子在水溶液中反应的离子方程式:______________。
(4)X元素的氢化物的沸点与同主族下一周期的元素的氢化物的沸点比较,沸点高的是(写化学式)
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程图生产的。流程图中:A和M(C3H4O)都可发生银镜反应,M和N的分子中碳原子数相同,A的烃基上的一氯代物有3种。
(1)写出下述物质的结构简式:A____________________,M___________。
(2)物质A的同类别的同分异构体的结构简式为________________________。
(3)N+B―→D的化学方程式为_________
(4)反应类型:X为________,Y为_____。
(5)N在一定条件下可以与水反应生成H,H中没有甲基。H也可以生成高分子化合物,写出生成该高分子化合物的化学方程式