用pH试纸测定某无色溶液的pH时,规范的操作是
| A.将pH试纸放入溶液中,观察其颜色变化,跟标准比色卡比较 |
| B.将溶液倒在pH试纸上跟标准比色卡比较 |
| C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较 |
| D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较 |
下列各组离子一定能大量共存的是
A .在含有大量AlO的溶液中:NH、Na+、Cl-、H+
.在含有大量AlO的溶液中:NH、Na+、Cl-、H+
B.在强碱溶液中:Na+、K+、CO、NO
C.在PH=12的溶液中:NH、Na+ 、SO、Cl-
、SO、Cl-
D.在c(H+)=0.1mol·L-1的溶液中:K+、I-、Cl-、NO
下表列举的各组陈述中存在因果关系的是
| 编号 |
陈述I(原因) |
陈述II(结果) |
| A |
O3能吸收紫外线 |
高空中得O3层被称为地球的保护伞 |
| B |
向100ml0.1mol/L的AlCl3溶液中加入1.5g NaOH发生反应 |
Al(OH)3会完全溶解 |
| C |
钠原子核外电子数比铝少 |
钠的金属性比铝强 |
| D |
HClO和SO2都具有漂白性 |
将Cl2和SO2同时 通入品红溶液,品红褪色会更快 通入品红溶液,品红褪色会更快 |
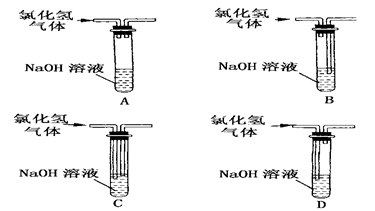
实验室常用水吸收氯化氢尾气,以防止环境污染。下列既能吸收尾气,又能防止水倒吸的装置是
氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
| A.一个D2O分子所含的中子数为8 | B.NH3的结构式为H— —H —H |
C.HCl的电子式为H+[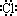 ] ] |
D.热稳定性:H2S>HI |
航天飞机 用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4
用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4 N2↑+4H2O+Cl2↑+2O2↑+Q。下列对此反应的叙述中错误的是
N2↑+4H2O+Cl2↑+2O2↑+Q。下列对此反应的叙述中错误的是
| A.上述反应中,每生成1molN2则转移电子6mol |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.反应从能量变化上说,主要是化学能转变为热能和动能 |
| D.在反应中高氯酸铵既起氧化剂,又起还原剂作用 |