全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:①
(写出离子方程式);②Br2+3CO32—=BrO3—+ 5Br—+3CO2↑;③BrO3—+ 5Br—+6H+=3Br2+3H2O。其中反应②中氧化剂是 ;还原剂是 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,
然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫的离子反应方程式:_ 。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是 。下列可以用于海水中溴的萃取试剂的 。
①乙醇 ②四氯化碳 ③硝酸 ④裂化汽油
(1)25 ℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-92.4 kJ/mol
2NH3(g)△H=-92.4 kJ/mol
①在该温度时,取l mol N2和3 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是_______92.4 kJ。(填“小于”, “大于” 或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是_______________。
| A.NH3生成的速率与NH3分解的速率相等 |
B.混合气体的反应速率 v正(NH3)=v逆(H2) v正(NH3)=v逆(H2) |
| C.容器内的密度不再变化 |
| D.单位时间内消耗a mol N2,同时生成2a mol NH3 |
(2) 25 ℃时,将工业生产中产生的NH3溶于水得0.1mol/L氨水20.0 mL,测得PH=11,则该条件下,NH3•H2O的电离平衡常数为__________。向此溶液中加入少量的氯化铵固体,此时 值将_____(填“增大”, “减小” 或“不变”)。
值将_____(填“增大”, “减小” 或“不变”)。
(3)常温下,向0.001mol/LAlCl3溶液中通入NH3直至过量,当PH=_________时,开始生成沉淀(已知:Ksp[Al(OH)3]=1.0×10-33)
充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)求该有机物的分子式。
(2)该有机物链状同分异构体的结构简式为:。
(3)若在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为。
分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图: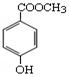
①下列对尼泊金酯的判断正确的是。
a.能发生水解反应 b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上 d.能与浓溴水反应产生白色沉淀。
② 尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是。
(2)C8H8O3的另一种同分异构体甲如图: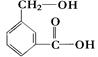
①请写出甲中所含官能团的名称,。
②甲在一定条件下跟Na反应的化学方程式是:。
③甲跟NaHCO3溶液反应的化学方程式是:。
从环己烷可制备1,4-环己二醇的二醋酸酯。下面是有关的8步反应(其中所有无机产物都已略去):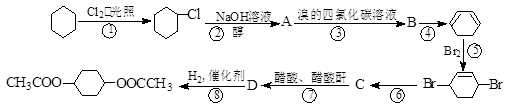
(1)化合物B、C的结构简式:B、C;
(2)属于取代反应分别是是反应①、、;(填序号)
(其中有3步属于取代反应、2步属于消去反应、3步属于加成反应)
(3)反应④的化学反应方程式为;该反应类型为。
写出下列化学反应方程式:
(1)溴乙烷与NaOH的乙醇溶液共热:。
(2)将CO2通入苯酚钠溶液中:。
(3)1,3-丁二烯的与Br2的1、4加成反应:。
(4)葡萄糖与银氨溶液发生银镜反应:。