科学家利用淡水与海水之间含盐量的差别发明了一种新型电池——水电池。
(1)用二氧化锰纳米棒作电池正极可提高发电效率,这是利用纳米材料的 特性,使之能与钠离子充分接触。
(2)水电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,该电池的负极反应式为 。水电池工作时,Na+不断向 极方向移动。
(3)水电池生成1 mol Na2Mn5O10转移电子的物质的量为 。
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如右图。请据右图分析: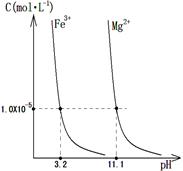
①该温度下,溶度积常数的关系为:KSP[Fe(OH)3] KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的FeCl3溶液,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是 。
碳及其化合物在工农业生产生活中有着重要作用。请按要求回答下列问题:
(1)已知:C(s)+O2(g) = CO2(g)△H =" -393" kJ•mol-1;
2CO(g)+O2(g) = 2CO2(g) △H =" -566" kJ•mol-1;
2H2(g)+O2(g) = 2H2O(g) △H = -484 kJ•mol-1
将水蒸气喷到灼热的炭上可实现炭的气化(制得CO、H2),该反应的热化学方程式为______________________________________________________________________。
(2)将一定量CO(g)和H2O(g)分别通入容积为2 L的恒容密闭容器中,一定条件下发生反应为CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组实验数据:
CO2(g)+H2(g),得到如下三组实验数据:
| 实验编号 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
500 |
4 |
8 |
3.2 |
4 |
| 2 |
750 |
2 |
4 |
0.8 |
3 |
| 3 |
750 |
2 |
4 |
0.8 |
1 |
①该反应的正反应为(填“吸热”或“放热”)反应。
②实验1中,0~4 min时段内,以v(H2)表示的反应速率为。若在此温度下H2O(g)、CO(g)起始量分别为2 mol、4 mol,则此反应的平衡常数为___________。
③实验2达到平衡时CO的转化率为。
④实验3与实验2相比,改变的条件是;
请在下图坐标中画出“实验2”与“实验3”中c(CO2)随时间变化的曲线,并作标注实验编号。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,该电池的负极反应式为____________________________________。
(4)一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物),则阴极的电极反应式为
______________________________________。
某同学用如下图所示装置,通过电解饱和食盐水探究氯气相关性质,其中A、B处的棉花浸有不同溶液。请按要求回答下列问题:
(1)图中Pt电极接电源________(填“正”、“负”)极,此电解总反应的离子反应方程式为_______________________________________________________________。
若在阴极产生448 mL气体(标准状况,假设完全从U形管右侧支管导出)后停止实验,测得U形管中溶液的体积为400 mL,则常温下此溶液的理论pH=_____________。
(2)上图实验装置设计存在不足,请在C处方框内画出简图补充完善,并标注必要试剂。
(3)通电一段时间后,可观察到A、B处的棉花颜色均发生变化。
①A处发生反应的离子方程式为_______________________________________。
②B处先变红,稍后又变为黄色。其中先变红的原因是____________________________。
(4)该同学为探究B处由红变黄的原因又进行了如下实验:
取出B处棉花挤出变黄的溶液样品分为两份,取其中一份于试管X中滴加KSCN溶液,得红色溶液。查资料知SCN-电子式: 。他猜想:SCN-可能被氯水氧化,导致溶液变黄。
。他猜想:SCN-可能被氯水氧化,导致溶液变黄。
①可能发生的反应为(请配平):
SCN-+ Cl2+
Cl2+ H2O = SO42-+ NO3-+
H2O = SO42-+ NO3-+ +
+ +CO2
+CO2
当0.5 mol SCN-参与反应时转移的电子总数目为_____________________。
②设计一简约实验验证此猜想成立:取第二份样品溶液于试管Y中,滴加_________;观察有_____________生成,则证明此设想成立。
化合物A(C5H8)是形成天然橡胶的单体,它的一系列反应如下图所示(部分反应条件略去):
已知:
请按要求回答下列问题:
(1)反应①和③的反应类型分别是_____________、_____________。
(2)A的官能团名称为_____________;
B的分子式为_________________;
B形成高聚物的结构简式为________________________________________。
(3)反应②的化学方程式为_________________________________________。
(4)C为一溴代物,分子中含 均2个,反应④的化学方程式为__________________________。
均2个,反应④的化学方程式为__________________________。
(5)A的名称是_____________________________。
写出所有符合下列条件的A的同分异构体的结构简式:
①环状②核磁共振氢谱显示有2种氢原子③不含立体结构
___________________________________________________________________。
A~I都是由短周期元素组成的常见物质,它们之间的转化关系如下图所示。已知:A为气体,其水溶液呈碱性;D、F均能与人体血液中的血红蛋白结合而使人中毒;E可作为半导体材料。
(1)化合物A的电子式为_______________________。
氧化物I中化学键类型:_____________________。
组成E单质的元素在元素周期表中的位置是____________________________。
图中物质所含元素原子的半径由大到小依次是(写元素符号)_____________。
(2)反应④的化学方程式为______________________________________________。
(3)将F与B按体积比2:1混合生成气体M,常温下测定M相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)___________________。
(4)某容积为V L的试管中充满F气体(标准状况下),若将该气体完全被水吸收,需通入B的物质的量为(写含V的表达式)_______________mol,此时所得溶液中再通入气体A,恰好完全反应后所得溶液中各离子浓度由大到小依次为:_________________________。
CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
2CO(g)+2H2(g)。平衡体系中各组分的浓度为:
| 物 质 |
CH4 |
CO2 |
CO |
H2 |
| 平衡浓度(mol·L-1) |
0.5 |
0.5 |
2.0 |
2.0 |
①此温度下,该反应的平衡常数K=__________________(注明单位)。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1=a kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2(g) △H2=b kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H3=c kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H=________kJ·mol-1。
2CO(g)+2H2(g)的△H=________kJ·mol-1。
(2)用Cu2Al2O4做催化剂,发生反应: CO2+CH4 CH3COOH, 请回答:
CH3COOH, 请回答:
①温度与催化剂的催化效率和乙酸的生成速率如图。
250~300℃时,温度升高而乙酸的生成速率降低的原因是。
②为提高上述反应CH4的转化率,可采取的措施有(写2种)。
③Cu2Al2O4可溶解在稀硝酸中,被氧化的元素为,每消耗3mol Cu2Al2O4时被还原的HNO3为mol。
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是。
a.可在碱性氧化物中寻找
b.可在具有强氧化性的物质中寻找
c.可在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO 4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式。