NA表示阿伏加德罗常数的值。下列说法中,正确的是
| A.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA |
| B.电解精炼铜时,当电路中转移NA个电子,阳极溶解32 g铜 |
| C.向仅含0.2 mol FeI2的溶液中持续通入氯气,当有0.1 mol Fe2+被氧化时,转移电子的数目为0.5NA |
| D.将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA |
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是
① 过滤② 蒸发 ③ 溶解④ 向容量瓶转移液体
| A.①和② | B.①和③ | C.③和④ | D.①和④ |
标准状况下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是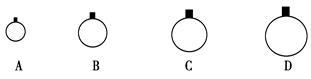
在温度、容积相同的三个密闭容器中发生反应N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H=﹣92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molN2、3molH2 |
2molNH3 |
4molNH3 |
| NH3的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
| 体系压强 |
P1 |
P2 |
P3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
下列说法正确的是
A.2 c1>c3B. a+b="92.4" C. 2P1<P3D. α1+α3=1
H+浓度相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的体积相等,则下列说法正确的是
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A ⑤盐酸中有锌剩余 ⑥醋酸中有锌剩余
| A.③④⑤ | B.③④⑥ | C.②③⑤ | D.②③⑤⑥ |
25℃时,水中存在电离平衡:H2O  H++OH- △H>0。下列叙述正确的是
H++OH- △H>0。下列叙述正确的是
| A.将水加热,KW增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,KW不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |