KNO3和KCl在不同温度时的溶解度如下表所示,请回答下列问题:
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
| 溶解度/g |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
| KCl |
27.6 |
31.0 |
34.6 |
37 |
40.0 |
42.6 |
45.5 |
48.3 |
(1)依据上表数据,已经绘出KNO3和KCl的溶解度曲线如图,图中能表示KNO3溶解度曲线的是 .(填“m”或“n”)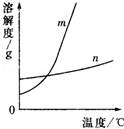
(2)10℃时,将50g溶质质量分数为10%的KCl溶液配制为质量分数为5%的溶液,加水质量为 g.
(3)根据溶解度曲线可以知道,若从m的饱和溶液中析出晶体,应该采用 结晶的方法.
用化学用语表示:
(1)实验室可以在常温下制得氧气,试写出其化学方程式:;
(2)赤铁矿中的主要成分是Fe2O3,焦炭在高温条件下可以与其反应生成铁和二氧化碳,所发生反应的化学方程式为;
(3)经总结发现在初中所学的四种基本反应类型中,生成物均可能有水产生,请写一个有水生成的置换反应的化学方程式。
已知反应前后分子变化的微观示意图如下所示。下列说法错误的是
A.化学方程式为CH4+2O2 CO2+2H2O
CO2+2H2O
B.A是有机物,B、C、D是无机物
C.此变化符合质量守恒定律
D.此反应为中和反应
化学实验技能是学习化学和进行探究活动的基础和保证.某化学兴趣小组进行了一些实验,主要操作过程如图所示: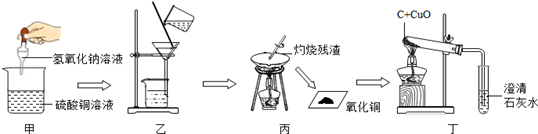
请回答下列问题:
(1)实验甲中配制氢氧化钠溶液时,氢氧化钠固体用托盘天平称量时应该放在________内,所需的硫酸铜溶液在配制前应先将硫酸铜晶体研碎,其实验目的是_______________________,甲烧杯内的实验现象是.
(2)实验乙、丙中均使用到了玻璃棒.玻璃棒属于(选填“金属”、“无机非金属”、“合成”或“复合”)材料.
(3)下列实验中要使用玻璃棒的是(填序号).
| A.稀释浓硫酸 | B.硫在氧气中燃烧 |
| C.用PH试纸测肥皂水的PH | D.实验室制取二氧化碳 |
(4)实验丁中将氧化铜和木炭粉混合物加入试管中的正确操作是_________
(5)丁实验结束时先进行的操作是__________(填序号)
①停止加热 ②从石灰水中移出导管
随着人们生活水平的不断提高,汽车已走进千家万户.制造汽车要用到含铜、铁、铝等成分的多种金属材料.
(1)在汽车电路中,经常用铜作导线,这是利用了铜的性.
(2)车体多用钢材制造.其表面喷漆不仅美观,而且可有效防止钢铁与接触而生锈.
(3)工业上用CO还原赤铁矿冶炼金属铁的化学方程式为.
(4)在实验室中探究铝、铁、铜的金属活动性顺序,需要用到硫酸铝、硫酸铜两种溶液和另一种药品是:.
现有下列6种物质,选择相应物质的化学式填空.
| A.小苏打 |
| B.氢气 |
| C.熟石灰 |
| D.葡萄糖 |
E.天然气
F.硝酸钾
(1)可作高能燃料用于航天
(2)可用于运动员补充能量
(3)可用于配制波尔多液
(4)可用于治疗胃酸过多
(5)可用于居民厨房燃料
(6)可作为农作物的复合肥料