如下图装置所示,是用氢氧燃料电池B进行的某电解实验: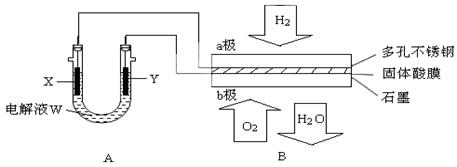
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:
Li2NH+H2=LiNH2+LiH ,则下列说法中正确的是 。
| A.Li2NH中N的化合价是-1 |
| B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H+的离子半径相等 |
| D.此法储氢和钢瓶储氢的原理相同 |
(2)在电池B工作时:
① 若用固体Ca(HSO4)2为电解质传递H+,则电子由 极流出,H+向 极移动。(填“a”或“b ”)
② b极上的电极反应式为:
③ 外电路中,每转移0.1 mol电子,在a极消耗 L的H2(标准状况下)。
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
① 电解池中X极上的电极反应式是 。在X极这边观察到的现象是 。
② 检验Y电极上反应产物的方法是 。
③ 若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是 。
化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知: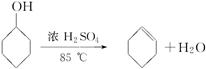
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
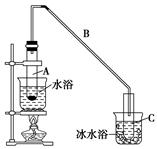
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片(防止爆沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液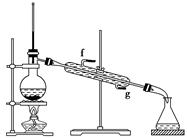
②再将环己烯按上图装置蒸馏,冷却水从________口进入(填“g”或“f”)。蒸馏时要加入生石灰,其目的是_____________________________________。
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________。
A.蒸馏时从70 ℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点
来自石油的有机化工原料A,可以发生如下转化: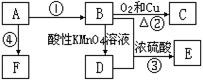
已知:E是具果香味的有机物,F是一种高分子化合物。请回答下列问题。
(1)A的分子式是_______________,C的名称是______________。
(2)D分子中的官能团名称是___________,证明 该官能团具有酸性的方法是________________________________________________________________________。
(3)反应③的化学方程式是_______________________________________________________,该反应属于____________反应。
反应④的化学方程式是 _______________________________________________________,该反应属于____________反应。
A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是 ____________族。
(2)画出D元素的原子结构示意图____________。
(3)与E的氢化物分子所含电子总数相等的分子是____________(举一例、填化学式),离子是____________(举一例、填电子式)。
(4)A与C形成的化合物中含有的化学键的类型是____________。
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式是__________________________________________。
将下列物质进行分类:
①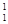 H与
H与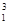 H;
H;
②O2与O3;
③乙醇(C2H5OH)与甲醚(CH3—O—CH3);
④正丁烷(CH3CH2 CH2 CH3)与异丁烷(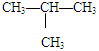 ) ,
) ,
⑤甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是(填序号、下同);
(2)互为同系物的是;
(3)互为同分异构体的是。
在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
3Fe(s)+4H2O(g)  Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。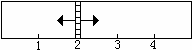
当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
(1)若x=1.5,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使反应维持向该方向进行,则x的取值范围是________________。
(2)若x=2,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为_________。