已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: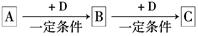
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为 。
(2)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明) 。
(3)若D是一种常见的温室气体,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,固体C受热分解可得固体B,该反应的化学方程式是 。
(4)若D为氯碱工业的主要产品,B具有两性,则B转化为C的离子方程式为 。
(5)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则元素D在周期表中的位
置是 ,B分子的结构式为 。
已知A、B、c、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B原子的L层p轨道中有5个电子;C是周期表中1-18列中的第14列元素;D和E属同一周期,又知E原子的L层电子数与最外层电子数之比为4:1,其d轨道中的电子数与最外层电子数之比为5:1,D跟B可形成离子化合物,其晶胞结构如右图。请回答:
(1)A与c形成的共价化合物的分子式是,杂化轨道是____,分子的立体结构是____。
(2)B与C比较,电负性较小的是(填元素符号);B与c形成的化合物晶体类型是。
(3)E属元素周期表中第周期,第族的元素,其元素名称是,
它的+2价离子的电子排布式为。
(4)从图中可以看出,D踉B形成的离子化合物的化学式为;若设该晶胞的边长为a cm,则该离子化合物晶体的密度是(只要求列出算式)。
CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。
(1)其中一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)===C2 H4(g)+3O2(g)△H=十1411.0kJ/mol
2CO2(g) +3H2 O(l)=C2 H5OH(1)十3O2(g)△H = +1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为。
(2)在一定条件下,6H2(g)+2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
 温度(K) 温度(K)CO2转化率(%) n(H2)/n(CO2) |
500 |
600 |
700 |
800 |
| 1.5 |
45 |
33 |
20 |
12 |
| 2 |
60 |
43 |
28 |
15 |
| 3 |
83 |
62 |
37 |
22 |
根据上表中数据分析:
①温度一定时,提高氢碳比[著轰击],CO2的转化率(填“增大”“减小”
“不变”)。
②该反应的正反应为(填“吸”或“放”)热反应。
(3)定条件下,将3 molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g) CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是____。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是____。
a.该条件下此反应的化学平衡常数表达式为
b.H2的平均反应速率为0.3mol/(L.s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是(填“乙醇”或“氧气”),b处电极上发生的电极反应是:。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 ,则生成沉淀所需CaCl2溶液的最小浓度为。
,则生成沉淀所需CaCl2溶液的最小浓度为。
“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请你回答以下问题:
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备: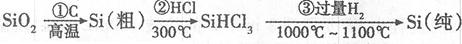
①写出步骤①的化学方程式。
②步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点—84.7℃),提纯SiHCl3的主要化学操作的名称是。
(2)磁性材料。这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的防护。最常见的铁制品腐蚀就是电化学腐蚀,请写出最为普遍的电化学腐蚀的负极反应式。
(3)激光材料。我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:,。
(4)纳米材料。胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,胶体粒子的直经大约是,三氯化铁溶液可以加速伤口止血,请简述原因。
(5)高分子材料。可以分成无机高分子材料和有机高分子材料。一种新型高效净水剂[A1Fe(OH)nCl6—n]m就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为;一种合成纤维腈纶,又称“人造羊毛”,由丙烯腈(CH2==CH—CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式。
从NO3-、SO42-、H+、Cu2+、Ba2+、Ag+、Cl-等离子中选出适当的离子组成电解质,采用惰性电极对其溶液进行电解。若两极分别放出气体,且体积比为1∶1,电解质的化学式可能是。
有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是