二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。探究二氧化硫的制取和性质都有着非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-1价)在高温下和氧气反应制备SO2: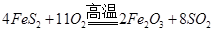
该反应中被氧化的元素是__________(填元素符号)。当该反应转移5.50mol电子时,生成的二氧化硫在标准状况下的体积为________L。
(2)①实验室可用70%的浓硫酸和亚硫酸钠反应制取二氧化硫,如果能控制反应速度,下图中可选用的发生装置是_______(填写字母)。
②若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有4.0%亚硫酸钠(质量分数)被氧化成硫酸钠,则至少需称取该亚硫酸钠_______g(保留一位小数)。
(3)某化学兴趣小组设计用如图装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为___________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入BaCl2溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入AgNO3溶液,有白色沉淀生成
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为______________。
已知乙烯能发生以下转化: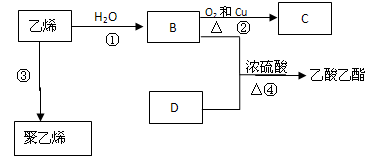
(1)乙烯的结构式
(2)B中官能团名称为,D中官能团名称为
(3)上述B+D的反应中,浓硫酸的作用是
(4)写出反应的化学方程式
反应②:
反应④:
(5)某同学用如图所示的实验装置制取少量乙酸乙酯。
实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因
②左边试管中放入碎瓷片的作用是
③右边试管甲在反应前加入的是饱和碳酸钠溶液,其目的是
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。(B中装的是无水硫酸铜)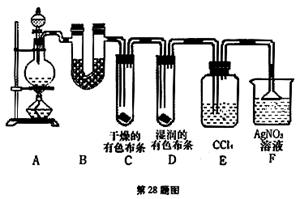
(1)装置A的作用是制取氯气,其反应的化学方程式为:
(2)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是
(3)①装置B的作用是,现象是。
②装置C和D出现的不同现象说明的问题是。
③装置E的作用是。
④写出装置F中发生反应的离子方程式。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在与之间(填装置字母序号),装置中应放入试剂。
(12分)Ⅰ试写出中学阶段常见的两种制取氧气的化学方程式:
;。
Ⅱ.实验室中通常用MnO2作催化剂分解过氧化氢,已知CuSO4溶液对过氧化氢的分解也具有催化作用,某实验兴趣小组同学猜想其他盐溶液也可能在这个反应中起同样的作用,于是他们做了以下探究。请你帮助他们完成实验报告:
(1)实验过程:在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
实验现象:。
实验结论:FeCl3溶液可以催化分解H2O2。
(2)已知FeCl3在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
甲同学的猜想:真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想:真正催化分解H2O2的是FeCl3溶液中的Cl-。
你认为最不可能的是同学的猜想,理由是。
(3)同学们对余下的两个猜想,用实验进行了探究,并记录如下,请你仔细分析后填表:
实验过程实验现象结论
| 实验过程 |
实验现象 |
结论 |
| 向盛有5 mL 5%的H2O2溶液的试管中滴入少量的 HCl,把带火星的木条伸入试管. |
无明显现象 |
|
| 向盛有5 mL 5%的H2O2溶液的试管中滴入少量的Fe2(SO4)3,把带火星的木条伸入试管. |
试管中有大量气泡产生,带火星的木条复燃 |
已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比。实验装置如图所示(已知CuO可以作为碳氢化合物燃烧的催化剂):
(1)若A装置中所盛放的药品是浓NaOH 溶液,写出装置A的一种作用:_
(2)C装置中所盛放的药品是:
(3)D装置中所盛放的药品是:
(4)E装置中所盛放的药品是:
(5)上述装置中有一处错误, (不考虑
酒精灯和加热方法可能存在的错误;
若增加仪器和药品,请指明仪器、药
品名称和位置):其改正方法是
(6) 若实验装置经过改正后,进行如下定量实验:准确称取7.2 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,U形管C管质量增加10.8 g,广口瓶D质量增加22 g,则该有机物的最简式为
(7)若能确定其分子式,则其同分异构体中沸点最低物质的名称__ (习惯命名法)。
某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
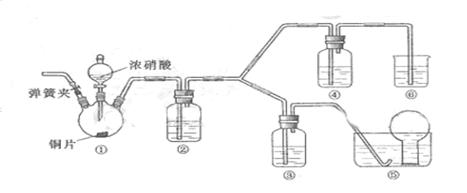
可选药品:浓硝酸、3mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液与NO不反应,能与NO2反应2NO2+2NaOH=NaNO3+ NaNO2+H2O
(1)实验应避免有害气体排放到空气中,装置③、⑥中盛放的药品依次是
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品后,还应进行哪些操作
再滴加浓硝酸与铜反应。
(3)装置①中发生反应的化学方程式是
(4)装置②的作用是,发生反应的化学方程式是
(5)该小组得出的结论依据的实验现象是