向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示。下列判断正确的是
| A.原NaOH溶液的浓度为0.1 mol/L |
| B.通入CO2的体积为448 mL |
| C.所得溶液的溶质成分的物质的量之比为n(NaOH):n(Na2CO3) =" 1:" 3 |
| D.所得溶液的溶质成分的物质的量之比为n(NaHCO3):n(Na2CO3) =" 2:" 1 |
下列有关物质的性质和该性质的应用均正确的是
| A.炭具有强还原性,高温下能将二氧化硅还原为硅 |
| B.Na的金属性比Mg强,可用Na与MgCl2溶液反应制取金属Mg |
| C.光照时乙烷和氯气能发生取代反应,工业上常用该反应生产氯乙烷 |
| D.二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
用H2O2溶液处理含NaCN的废水的反应原理为:NaCN+H2O2+H2O=NaHCO3+NH3,已知:HCN的酸性比H2CO3弱。下列有关说法正确的是
| A.该反应中氮元素被氧化 |
| B.该反应中H2O2作还原剂 |
| C.0.1mol·L-1NaCN溶液中含有HCN和CN-的总数为0.1×6.02×1023 |
| D.实验室配制NaCN溶液时,需加入适量的NaOH溶液 |
下列有关化学用语表示正确的是
A.质子数为53、中子数为78的碘原子: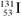 |
B.N2的电子式: |
C.S2-的结构示意图: |
| D.丙醛的结构简式:CH3CH2COH |
21世纪化学的最新定义为“化学是一门创造新物质的科学”。下列有关说法不正确的是
| A.用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用 |
| B.开发利用太阳能、生物质能等清洁能源,有利于节约资源 |
| C.绿色化学的核心是应用化学原理对环境污染进行治理 |
| D.制备物质时探究反应中高的选择性、转化率和原子利用率,属于“绿色”的生产工艺 |
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g)∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g)∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min |
n(SO2)/mol |
n(O2)/mol |
| 0 |
2 |
1 |
| 5 |
1.2 |
|
| 10 |
0.4 |
|
| 15 |
0.8 |
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1·min−1
B.保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%