工业制钛白粉产生的废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生产补血剂乳酸亚铁。其生产流程如下:
已知:TiOSO4可溶于水,在水中电离为TiO2+和SO42-。请回答下列问题:
(1)写出TiOSO4水解生成钛酸H4TiO4的离子方程式 。步骤①中加入足量铁屑的目的是 。
(2)工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法(剑桥法)生产钛 是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_______________。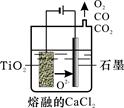
(3)步骤②的离子方程式是 ,所得副产品主要 是__________(填化学式)。
(4)步骤④的结晶过程中必须控制一定的真空度,原因是 。
(5)乳酸可由乙烯经下列步骤合成:
上述合成路线的总产率为60%,乳酸与碳酸亚铁反应转化为乳酸亚铁晶体的产率为90%,则生产468 kg乳酸亚铁晶体(M=234 g/mol)需要标准状况下的乙烯 m3。
①~⑧是元素周期表中的部分元素。
 族 族周期 |
IA |
0 |
||||||
| 1 |
① |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
请回答:
(1)元素③④⑧的气态氢化物中最稳定的是__________(填化学式)。
(2)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是__________。
(3)元素⑥和⑧形成的化合物的电子式是__________。
(4)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。请回答:
a. X是__________(填化学式),B装置的作用是__________。
b. 能说明元素②和硅元素非金属性强弱的实验现象是__________,相关的化学方程式是__________。同主族元素从上到下__________,得电子能力逐渐减弱,非金属性逐渐减弱。
(5)请设计实验比较元素⑥与⑦金属性的相对强弱__________。
为了研究外界条件对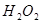 分解反应速率的影响,某同学在四支试管中分别加入
分解反应速率的影响,某同学在四支试管中分别加入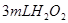 溶液,并测量收集
溶液,并测量收集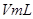 气体所需的时间,实验记录如下:
气体所需的时间,实验记录如下:
| 实验序号 |
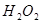 溶液浓度 溶液浓度 |
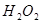 溶液温度 溶液温度 |
催化剂 |
所用时间 |
| ① |
5% |
20℃ |
2滴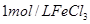 |
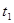 |
| ② |
5% |
40℃ |
2滴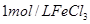 |
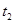 |
| ③ |
10% |
20℃ |
2滴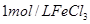 |
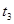 |
| ④ |
5% |
20℃ |
不使用 |
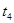 |
请回答:
(1)过氧化氢分解的化学方程式是__________。
(2)实验①②是研究__________对反应速率的影响。
(3)实验测得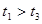 ,原因是__________。
,原因是__________。
(4)实验①④的测定过程如下图,曲线a对应的实验序号是__________(填“①”或“④”)。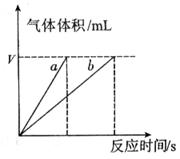
聚合物 的合成路线如下:
的合成路线如下:
(1)在合成 的反应路线中:
的反应路线中:
①生成A的反应类型是。
②由B生成 的化学方程式是。
的化学方程式是。
③聚合物 的结构简式是。
的结构简式是。
(2) 的结构简式是。
的结构简式是。
(3)①D的名称是。
②写出生成 的化学方程式。
的化学方程式。
(4)在合成 的反应路线中:
的反应路线中:
①H的分子式是 ,写出
,写出 的化学方程式。
的化学方程式。
②下列说法正确的是。
a. 乙烯与H互为同系物
b. H的同分异构体中存在芳香烃
c. N分子中可能存在碳碳双键
d. H→N的反应原子利用率是100%
工业上常用天然气作为制备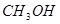 的原料。已知:
的原料。已知:
①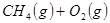
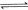
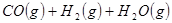
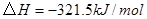
②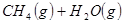
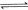
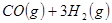
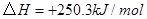
③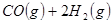
(1)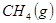 与
与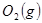 反应生成
反应生成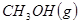 的热化学方程式为。
的热化学方程式为。
(2)向VL恒容密闭容器中充入 与
与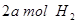 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。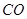 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: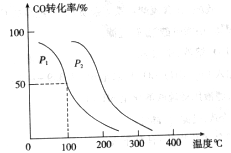
①压强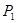
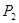 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在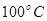 、
、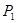 压强时,平衡常数为(用含
压强时,平衡常数为(用含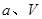 的代数式表示)。
的代数式表示)。
(3)下图是甲醇燃料电池(电解质溶液为稀硫酸)结构示意图,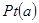 电极通入的
电极通入的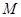 为,电极反应式是。
为,电极反应式是。
若用该电池电解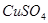 溶液,当得到
溶液,当得到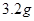 铜时,参加反应的气体
铜时,参加反应的气体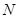 的体积应为
的体积应为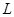 (标准状况)。
(标准状况)。
某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的 。
。
I.取工业硫酸铜固体,用稀硫酸溶解,过滤。
II.向滤液中滴加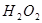 溶液,稍加热。
溶液,稍加热。
III.向II的溶液中加入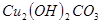 粉末至
粉末至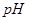 为
为 。
。
IV.加热煮沸,过滤,滤液用稀硫酸酸化至 。
。
V. 加热浓缩、冷却结晶、过滤,得晶体。
已知部分阳离子生成氢氧化物的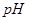 如下表:
如下表:
| 物质 |
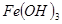 |
 |
 |
开始沉淀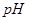 |
2.7 |
7.6 |
4.7 |
完全沉淀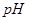 |
3.7 |
9.6 |
6.7 |
(1)II中发生反应的离子方程式是。
(2)II中将 氧化为
氧化为 的目的是。
的目的是。
(3)用 (铁氰化钾)验证II中
(铁氰化钾)验证II中 是否转化完全的现象是。
是否转化完全的现象是。
(4)III中发生反应的离子方程式是。
(5)应用化学平衡移动原理解释IV中“滤液用稀硫酸酸化”的原因。