已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上的气态化合物,则:
(1)写出下列元素名称:X是________,Z是________。
(2)由Y和Z组成,且Y和Z的质量比为7∶20的化合物的分子式是________。
(3)写出由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的阴、阳离子分别为_____和_____,其中阴离子的电子式为______________。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为4∶2∶3,该盐的化学式是__________;如果向该盐溶液中加入铜和稀硫酸,溶液变蓝色,试写出离子方程式______________________;如果将该盐固体与熟石灰混合加热,会产生一种刺激性气味的气体,试写出化学方程式__________________。
A、B、C、D、E五种物质的焰色反应都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气 体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,与过量的CO2反应生成E,E加热能生成D。试推断:
体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,与过量的CO2反应生成E,E加热能生成D。试推断:
A,B,C,D,E(写化学式),并写出有关反应的化学方程式:
A和水:
B和水:
C和少量的CO2:
C和过量的CO2:
E受热分解:
(15分)(物质结构与性质)CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知 :
:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为。H、N、O三种元素的电负性由大到小的顺序是 。
。
(2)SO2分子的空间构型为____________。与SnCl4互为等电子体的一种离子的化学式为
。
(3)乙二胺分子 中氮原子轨道的杂化类型为。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_。
中氮原子轨道的杂化类型为。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_。
(4)②中所形成的配离子中含有的化学键类型有_______。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
(5)CuCl的晶胞结构如右图所示,其中Cl原子的配位数为_____。
(有机化学)乙醇是一种重要的化工原料。
(1)葡萄糖在酒化酶的作用下转化为乙醇的化学方程式是。
(2)香豆素是一种用途广泛的香料,它可以利用乙醇和B通过以下途径合成。 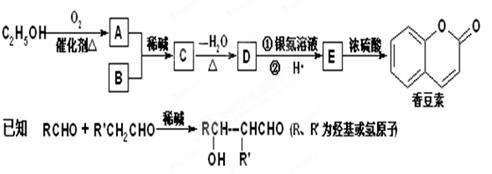
① D的结构简式是;
② 完成下列化学方程式:
E在一定条件下发生加成聚合反应:;
E→香豆素:;
③ B有多种同分异构体,其中含有苯环且核磁共振氢谱有四个峰的所有同分异构体的结构简式是;
④ 有关香豆素的说法正确的是(填字母)。
a.只能与溴单质发生加成反应,不能发生取代反应
b. 1mol香豆素可与5molH2发生加成反应
c. 1mol香豆素可与2molNaOH发生反应
d. 1mol香豆素完全燃烧消耗9.5molO2
(15分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵: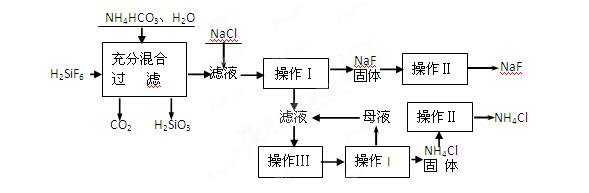
有关物质在水中溶解度(g/100gH2O)如下:
| 温度 |
10℃ |
20℃ |
30℃ |
溶解度:20℃NaF—4 0℃NH4F—100; 常温Na2SiF6微溶于水 |
| NH4Cl溶解度 |
33 .3 .3 |
37.2 |
41.4 |
请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有。
(2)上述流程中发生两步反应,化学方程式为:

(3)操作II的作用是
操作Ⅲ的具体过程是
(4)流程中NH4HCO3必须过量,其原因是
_______________________________________________________________________
二甲醚与水蒸气重整制氢气作为燃料电池的氢源,比其他制氢技术更有优势。主要反应为:
① CH3OCH3(g) + H2O(g) 2CH3OH(g) ΔH=+37 kJ·mol-1
2CH3OH(g) ΔH=+37 kJ·mol-1
② CH3OH(g) + H2O(g)  3H2(g) + CO2(g) ΔH=+49 kJ·mol-1
3H2(g) + CO2(g) ΔH=+49 kJ·mol-1
③ CO2(g) + H2(g) CO(g) + H2O(g) ΔH=+41.3 kJ·mol-1
CO(g) + H2O(g) ΔH=+41.3 kJ·mol-1
其中反应③是主要的副反应,产生的CO能毒害燃料电池Pt电极。请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为
。
(2)CH3OCH3(g)与水蒸气重整制氢气的热化学方程式为
。
(3)下列采取的措施和解释正确的是。(填字母序号)
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在低温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,对制取氢气不利,且对减少CO的产生几乎无影响
(4)在温 度相同的3个密闭容器中,按不同方式
度相同的3个密闭容器中,按不同方式 投入反应物,保持恒温、恒压,发生反应①,测得反应达到平衡时的有关数据如下。
投入反应物,保持恒温、恒压,发生反应①,测得反应达到平衡时的有关数据如下。
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol CH3OCH3、1mol H2O |
2mol CH3OH |
1mol CH3OH |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
吸收a kJ |
放出b kJ |
放出c kJ |
| 平衡时体积(L) |
V1 |
V2 |
V3 |
| 反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是。(填字母序号)
A. a+2c="37" B. α1 + α2="1"  C. V1 > V3D. c1=
C. V1 > V3D. c1= 2c3
2c3
(5)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极也可直接构成燃料电池。该电池中负极上的电极反应式是 。
。