把一定质量的铁完全溶解于某浓度的硝酸中收集到0.3 mol NO2和0.2 mol NO。向反应后的溶液中加入足量NaOH溶液充分反应,经过滤、洗涤后,把所得沉淀加热至质量不再减少为止。得到固体质量不可能为
| A.18 g | B.24 g | C.30 g | D.36 g |
在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表. 据此判断下列结论正确的是 ( )
据此判断下列结论正确的是 ( )
| 测定时刻/s |
t1 |
t2 |
t3 |
t 4 |
| c(A)/(mol/L) |
6 |
3 |
2 |
2 |
| c(B)/(mol/L) |
5 |
3.5 |
3 |
3 |
| c(C)/(mol/L) |
1 |
2.5 |
3 |
3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为:2A+B 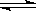 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)] mol·L-1·s-1
可逆反应mA(g)+nB(g)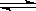 pC(g)+ gD(g)的v-t图象如下图甲,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如下图乙。
pC(g)+ gD(g)的v-t图象如下图甲,若其他条件都不变,只是在反应前加入合适的催化剂,则其v-t图象如下图乙。
①a1=a2 ②a1<a2 ③b1=b2 ④b1<b2 ⑤t1>t2⑥t1=t2
⑤t1>t2⑥t1=t2
⑦两图中阴影部分面积相等⑧乙图阴影部分面积更大
以上正确的为 ( )
| A.②④⑤⑦ | B.①④⑥⑧ | C.②③⑤ | D.①③⑥⑦ |
分析下表中的四个热化学方程式,判断氢气和丙烷的燃烧热分别是 ( )
| “嫦娥一号” 发射火箭燃料 |
液氢 (H2) |
①2H2(g)+O2(g)=2H2O(l) △H = -571.6kJ·mol-1 ②2H2(l)+O2(l)=2H2O(g) △H = -482.6kJ·mol-1 |
||||
| 北京奥运会 “祥云”火炬燃料 |
丙烷 (C3H8) |
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g) △H = - 2013.8kJ·mol-1 2013.8kJ·mol-1④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H = -2221.5kJ·mol-1
|
2g碳与水蒸气反应生成CO和H2,需吸收21.88kJ热量,此反应的热化学方程式为 ( )
| A.C + H2O ==CO + H2ΔH==+131.3kJ·mol—1 |
| B.C(s)+ H2O(g) ==CO(g) + H2(g)ΔH==+10.94kJ·mol—1 |
| C.C(s)+ H2O(g) ==CO(g) + H2(g)ΔH==-131.3kJ·mol—1 |
| D.C(s)+ H2O(g) ==CO(g) + H2(g)ΔH==+131.3kJ·mol—1 |
下列叙述错误的是( )
| A.钢铁表面发生吸氧腐蚀时,钢铁表面水膜的pH增大 |
| B.电解精炼铜,开始通电一段时间后,阳极溶解的铜的质量比阴极析出的铜的质量少 |
| C.在镀件上电镀锌,用锌作阳极 |
| D.工作时在原电池的负极和电解池的阴极上都是发生失电子过程 |