下列说法正确的是
A.一定条件反应:2CO(g)  CO2(g)+C(s)可自发进行,则该反应的△H>0 CO2(g)+C(s)可自发进行,则该反应的△H>0 |
| B.向硫酸亚铁溶液中滴加硫氰化钾溶液产生血红色沉淀说明溶液已变质 |
| C.在反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,当生成1.5mol Cl2时,反应中转移的电子数为2.5NA |
| D.相同物质的量浓度的下列溶液:①NH4HSO4②NH4Cl③NH3·H2O,水电离程度由大到小的顺序是:①>②>③ |
在核磁共振氢谱中出现两组峰,其氢原子数之比为3∶2的化合物是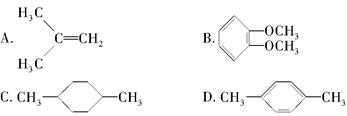
下列对有机物结构或性质的描述,错误的是
| A.一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
| B.甲苯与浓硝酸和浓硫酸的混酸反应制TNT体现了苯环对侧链的影响 |
| C.乙烷和丙烯的物质的量各1mol,完成燃烧都生成3molH2O |
| D.光照下2,2—二甲基丙烷与Br2反应其一溴取代物只有一种 |
下列化学用语正确的是
A.一氯甲烷的分子式:CH3Cl B .乙酸的实验式:C2H4O2
.乙酸的实验式:C2H4O2
C.乙炔的结构简式:CHCH D.羟基的电子式: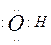
下列有机物命名正确的是
A. 2-乙基丙烷 2-乙基丙烷 |
B. CH 3CH2CH2CH2OH 1-丁醇 3CH2CH2CH2OH 1-丁醇 |
C. CH3- -CH3间二甲苯 -CH3间二甲苯 |
D. 2-甲基-2-丙烯 2-甲基-2-丙烯 |
下列卤代烃能发生消去反应的是