暗紫色化合物A具有绿色、高电压和高能量的特点,近年来引起了电化学界的高度重视。在常温和干燥的条件下,化合物A可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。某兴趣小组的同学对化合物A进行组成分析,确定A中仅含有O、K、Fe三种元素。取3.96g化合物A的粉末溶于水,滴加足量的稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A的化学式为 ;化合物A与H2O反应的离子方程式为 。
(2)化合物A还可作为一种“绿色高效多功能”水处理剂。原因是 。
(3)化合物A的制备还可通过氧化法,试写出在KOH存在条件下用次氯酸钾氧化氢氧化铁制备A的化学方程式 。
(4)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物A水溶液稳定性的是
| A.亚硫酸钠 | B.KOH | C.醋酸 | D.Fe(NO3)3 |
(5)为研究温度对化合物A水溶液稳定性的影响,请设计一个实验方案 。
由人尿分离出来的结晶化合物A,熔点为187—188℃。对化合物A作如下实验:
(1)测得A的蒸气密度为8.0 g·L-1(已折合成标况状况)。取17.92 g A完全燃烧,生成的气体通过浓H2SO4,使浓H2SO4增重8.10 g。剩余气体通过碱石灰,气体质量减轻39.60 g,另取17.92 g A完全分解,可得1.12 L(标况)氮气。试通过计算确定A的分子式。
(2)又已知A和足量6 mol·L-1的盐酸混合加热可以完全水解,1 mol A水解生成1 mol B和1 mol C。已知:A、B、C三种物质的分子中均含有一个羧基;B物质仅由C、H、O三种元素组成,其物质的量之比7∶6∶2;C的俗名为甘氨酸。写出A、B、C的结构简式:A___________________;B___________________;C___________________。
α-松油醇可经以下路线合成,小方框中的每一字母各代表一种有机物: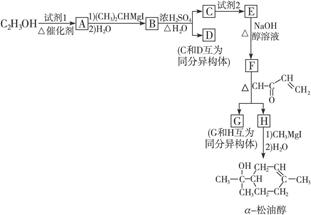
可供选择的试剂:①Br2②H2③O2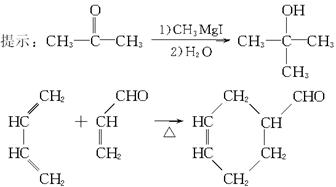 |
请回答下列问题:
(1)试剂1是___________,试剂2是___________。
(2)A至H中,能发生银镜反应的是_____________________________。
(3)G和H的结构简式分别是:G__________________;H__________________。
(4)E转化为F的反应方程式是__________________________________________。
300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构式为: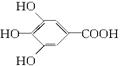
(1)用没食子酸制造墨水主要利用了___________类化合物的性质(填代号)。
| A.醇 | B.酚 | C.油脂 | D.羧酸 |
(2)没食子酸丙酯具有抗氧化作用,是目前广泛应用的食品添加剂,其结构简式为______________________________________________________。
(3)尼泊金丁酯是对羟基苯甲酸与醇形成的酯类化合物,是国家允许使用的食品防腐剂。尼泊金丁酯的分子式为_____________________________,其苯环只与—OH和—COOR两类取代基直接相连的同分异构体有_____________种。
(4)写出尼泊金乙酯与氢氧化钠溶液加热反应的化学方程式:______________________。
某一定量的苯的同系物完全燃烧,生成的气体通过浓硫酸后,质量减少10.8 g,再通过KOH溶液后,KOH溶液增重39.6 g,又知经氯代处理后该苯的同系物苯环上的一氯代物、二氯代物、三氯代物分别有一种,该苯的同系物的分子式为_______________,结构简式为______________________________。
现有A、B两种链状饱和一元醇的混合物0.3 mol,其质量为13.8 g。已知A和B碳原子数均不大于4,且A<B。
(1)混合物中A可能的分子式_______________;B可能的分子式_______________。
(2)若n(A)∶n(B)=1∶1时,A的名称_______________;B的名称_______________。
(3)若n(A)∶n(B)≠1∶1时,
A的结构简式为______________________________;
B的结构简式为______________________________;
则n(A)∶n(B)=______________________________。