加碘食盐中含有的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
(1)步骤②中氢氧化钾的主要作用是 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,可经过 、过滤、洗涤、干燥等步骤。
| 温度/℃ |
20 |
40 |
60 |
80 |
| KIO3/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
(3)已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-
为了测定加碘食盐中碘的含量,某学生设计了如下实验:准确称取wg食盐,加适量蒸馏水使其完全溶解;再用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;最后加入指示剂,以物质的量浓度为2.00×10-3mol·L-1的Na2S2O3溶液滴定,消耗10.00mL时恰好反应完全。
在滴定过程中,所用的玻璃仪器为 、 。
该实验可以用 作指示剂,滴定终点的现象是 。
③ 下列有关该滴定实验的说法不正确的是 。
A.滴定管在使用前必须检查是否漏水并润洗 B.滴定时眼睛注视滴定管内溶液液面变化
C.为减小实验误差,可用少量的蒸馏水冲洗锥形瓶内壁 D.终点读数时俯视会导致碘的含量偏低
④加碘食盐样品中的碘元素含量是 g·kg-1(以含w的代数式表示)。
Ⅰ某化合物结构简式如图,请根据所示的化合物回答问题: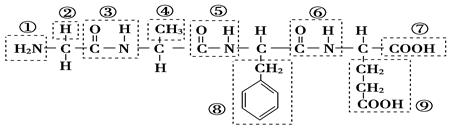
(1)该化合物中,官能团①的名称是________;官能团⑦的名称是________;该化合物是由________个氨基酸分子脱水形成的;
(2)写出该化合物水解生成的任意一种氨基酸与氢氧化钠溶液反应的化学方程式:_________________
Ⅱ食品安全关系着国民生计,影响食品安全的因素很多。
(3)聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
)具有超强阻隔性能,可作为保鲜食品的包装材料。它是由________(写结构简式)发生加聚反应生成的。
(4)劣质植物油中的亚油酸[CH3(CH2)4—CH===CH—CH2—CH===CH—(CH2)7COOH]含量很低。下列关于亚油酸的说法中,正确的是________。(填序号)
| A.分子式为C18H34O2 |
| B.一定条件下能与甘油(丙三醇)发生酯化反应 |
| C.能和NaOH溶液反应 |
| D.能使酸性KMnO4溶液褪色 |
(5)假酒中甲醇(CH3OH)含量超标,请写出Na和甲醇反应的化学方程式:______________________。
(6)淀粉最终的水解产物是葡萄糖。请设计实验证明淀粉已经全部水解,写出操作、现象和结论:______________。
把6.5gZn放入足量盐酸中,Zn完全反应,计算生成H2的体积(标准状况)
用不含Fe3+ 的FeSO4 溶液与用不含O2的蒸馏水配制的Na溶液反应制备氢氧化亚铁。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________________
(2)除去蒸馏水中溶解的氧气常采用的方法是________________
(3)生成白色Fe(OH)2沉淀的操作使用长滴管吸取不含O2 的NaOH溶液,插入FeSO4溶液液面以下,再挤出NaOH溶液。这样操作的理由是___________________________________________________
A、B、C、D、E五种物质的焰色反应都显黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能变成D。写出A~E的化学式:A____________、
B____________、C____________、D______________、E______________。
(8分)分析氧化还原反应并填空WO3+H2 W+3H2O
W+3H2O
氧化剂_____________,还原剂________ 氧化产物________,还原产物__________