制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g)  CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
某温度下体积为10L的密闭容器中,测得各物质的物质的量数据如下:
| 物质的量mol |
0min |
2 min |
3 min |
4 min |
| NH3 |
2.0 |
1.4 |
n1 |
n1 |
| CO2 |
1.0 |
0.7 |
n2 |
n2 |
| H2O |
0 |
0.3 |
n3[ |
n3 |
(1)根据表中数据计算0~2min内NH3的平均反应速率 ,若起始时与平衡时的气体总压强之比为15/11,n1= mol。
(2)该温度下此反应的平衡常数表达式为
(3)下列各项能表示该反应达到平衡状态是 。
A.消耗NH3的物质的量与生成H2O的物质的量之比为2∶1
B.c(NH3):c(CO2):c(H2O)=2∶1∶1
C.气体密度不再变化
D.容器压强不再变化
现有S2-、NH4+、Na+、(SO4)2-、Fe3、ClO-等离子,请按要求填空:
(1)在水溶液中,该离子水解呈碱性的是__________。
(2)在水溶液中,该离子水解呈酸性的是_________。
(3)不能在酸性较强的溶液里大量存在的离子有_________。
(4)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有__________。
把一只表面被氧化成10.2 g氧化铝的铝条A,放入1 L 1.5 mol/L的热氢氧化钠溶液中,过一段时间后取出铝条,溶液质量增加12.6克,此溶液称为甲溶液,体积仍为1 L,再把另一只表面也氧化成一定量的氧化铝的铝条B,放入1 L 0.9 mol/L的硫酸溶液中,,过一段时间取出,其质量减少25.8克,溶液质量增加25.2克,此溶液称为乙溶液,体积仍为1 L,回答下列问题:
(1)甲溶液溶质是 (写化学式),其物质的量是 ;
(2)乙溶液的溶质 (写化学式),其物质的量是 ;
(3)将甲乙两溶液反应,若使滴加的量最小,产生沉淀最多,应将 溶液 (填甲、乙)L 滴加到 溶液中(填甲、乙)。
I.根据反应3Cu+8HNO33Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)氧化剂是 ,元素被氧化;
(2)用“双线桥”表示该反应电子转移的方向和数目:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,转移的电子数为 ;
II. 有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请将这6种物质组成一个化学方程式(需配平):
2002年9月26日,中国北京曙光公司研制出了第一款具有我国完全自主知识产权的高性能CPU芯片— “龙芯”1号。该芯片中主要成分可以制成计算机长距离联网传输的线路材料,这种埋在地下的材料如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因
I. 今有H2、Cl2混合气100 mL(标况),其中一种气体的体积为45mL。光照使两种气体发生反应后恢复到标况,气体体积为mL。为了说明反应后气体中H2或Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后恢复到标况,
(1)若仍剩余___mL,证明有___剩余,理由是_____;
(2)若溶液有___性质,证明有___剩余,理由是________________________。
II.一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图所示)。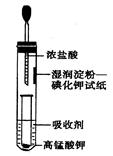
(1)下列溶液能吸收Cl2的是________。
| A.饱和食盐水 | B.Na2SO4溶液 |
| C.NaOH溶液 | D.浓硫酸 |
(2)能说明Cl2的氧化性强于I2的实验现象是_______________________。
(3)实验室制取氯气的离子方程式__________________________。
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。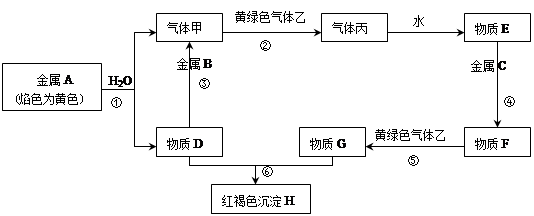
请回答下列问题:
(1)写出下列物质的化学式:B、丙、乙。
(2)写出下列反应的化学方程式:
反应①;
反应⑤;
反应⑥。