I. 今有H2、Cl2混合气100 mL(标况),其中一种气体的体积为45mL。光照使两种气体发生反应后恢复到标况,气体体积为 mL。为了说明反应后气体中H2或Cl2有剩余,使气体通过10 mL水,并使剩余气体干燥后恢复到标况,
(1)若仍剩余___mL,证明有___剩余,理由是_____;
(2)若溶液有___性质,证明有___剩余,理由是________________________。
II.一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如图所示)。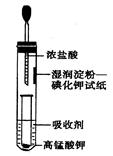
(1)下列溶液能吸收Cl2的是________。
| A.饱和食盐水 | B.Na2SO4溶液 |
| C.NaOH溶液 | D.浓硫酸 |
(2)能说明Cl2的氧化性强于I2的实验现象是_______________________。
(3)实验室制取氯气的离子方程式__________________________。
T℃时,A、B、C三种气体在反应过程中的浓度变化如图1所示,若保持其它条件不变,温度分别为T1℃和T2℃时,B的浓度变化与时间的关系示意图如图2所示。
请回答下列问题:
(1)该反应的化学反应方程式是:
(2)比较大小:
A和B的转化率AB,原因是
温度的高低T1T2,判断依据是
(3)若其它条件不变,反应进行到(t1+10)min时,A的浓度为
在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在
催化剂存在的条件下进行下列反应:2A(g)+3B(g)  3C(g),2分钟达到平衡,生成1.5 mol
3C(g),2分钟达到平衡,生成1.5 mol
C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当
反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1)该反应在30℃时平衡常数K1=,焓变△H0(填“>”、“<”或“=”)。
(2)该反应在30℃时平衡混合气中C的体积分数为ω1=;从反应开始到达到化学平衡状态时v(A)=____________mol/(L·min)
(3)该反应在70℃时平衡常数为K2,则 K1K2(填“>”、“=”或“<”)
(4)70℃时,若保持温度不变,在2 L的密闭容器中加入4 molA和6 molB,当反应重新达到平衡时,C的体积分数为ω3,则ω3ω2 (填“>”、“<”或“="”" )。
(5)可以判断2A(g)+3B(g)  3C(g) 反应已经达到平衡的是( )
3C(g) 反应已经达到平衡的是( )
A.2v(B)=3v(A)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.混合气体的平均相对分子质量不再改变
E.n(A)∶n(B)∶n(C)=2∶3∶3
研究NO2、SO2、CO等大气污染气体的处理以及燃料的开发与利用有重要意义。
(1)NO2可用水吸收,利用反应6NO2+8NH3 7N2+12H2O
7N2+12H2O
也可以处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是______________L。
(2)已知:2SO2(g)+ O2 (g)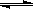 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 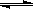 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) 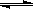 SO3 (g) +NO(g)的△H =______kJ·mol-1
SO3 (g) +NO(g)的△H =______kJ·mol-1
(3)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g) 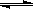 CH3OH (g)。由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
CH3OH (g)。由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
①该电池反应的总离子方程式为____________________________________________。
②甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____________(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的O2________________升。
现有四种短周期元素X、Y、Z、W,其中:
① X、W原子的电子层数与最外层电子数之比分别为3:1和1:3
② Y原子是元素周期表中原子半径最小的
③ Z是形成化合物种类最多的元素
回答下列问题:
(1)X元素在周期表中的位置是 。
(2)上述四种元素中所能组成的含有非极性共价键的化合物的分子式 (填其中一种即可)。
(3)化合物X2W2的电子式是 。
(4)向含1 mol Na2SiO3的溶液中缓慢通入2 mol的ZO2,反应的离子方程式是 。
(5)由Y、Z、W元素中的两种或三种可以组成多种分子,其中含有10个电子的分子是_________(填化学式)。
(6)向25.00 mL的Y2Z2W4溶液中加入5.00 mL 0.50 mol/L酸性KMnO4溶液恰好完全反应,得到ZO2和Mn2+,则此种Y2Z2W4溶液的物质的量浓度是 mol/L。
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物, E的阳离子与A的阴离子核外电子层结构相同。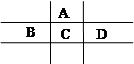
请回答下列问题:
⑴C元素在周期表中的位置为。
⑵写出A与氢元素能形成原子物质的量之比为1∶1的化合物的结构式,分子中所含共价键的类型为。
⑶比较A、C氢化物的稳定性:AC(填大于、小于或等于),原因是。
⑷B、C、D的原子半径由大到小的顺序为(用元素符号表示)。
⑸若将E制作成电极与石墨用导线相连,回答下列问题:
将两电极插入盛有稀H2SO4的烧杯中形成原电池,E电极为极,写出该电池的负极的电极反应是:;电池总反应(用离子方程式表示)。