将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示。
提示:Na2CO3与盐酸是分步进行的,第一步为Na2CO3+HCl=NaHCO3+NaCl;第二步为NaHCO3+HCl=NaCl+H2O+CO2↑。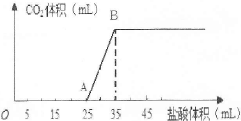
请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有 (填化学式)。
(2)当到达B点时,产生CO2的体积为 mL(标准状况)。
(3)计算原混合物中Na2CO3的质量分数。(写出计算过程,结果保留小数点后一位)
用如下图所示装置可以完成一系列实验(图中夹持装置已略去)
请回答下列问题:
I.(1)仪器p的名称是_________________,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 |
① |
② |
③ |
| 所蘸试剂 |
石蕊试液 |
品红溶液 |
碘水(黄色) |
| 现象 |
褪色 |
||
| 体现SO2的性质 |
水溶液显酸性 |
(2)写出③中反应的离子方程式_________________________________________。
II.若用装置A由浓盐酸和高锰酸钾制取Cl2气体,装置B中的四处棉花依次做了如下处理:①蘸有FeCl2溶液②蘸有淀粉KI溶液③蘸有石蕊溶液④蘸有品红溶液
(1)写出①处发生反应的离子方程式_______________________________________。
(2)在实验过程中,③处能观察到的现象___________________________________。
(3)写出装置C中“吸收多余气体”所用的试剂_______________________________
(10分) 铝是一种重要金属:
(1)生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与磁性氧化铁发生反应的化学方程式为 。该反应中氧化剂是 ,还原剂是 ,要得到1mol金属铁,需要铝的质量 g。(2) 铝与NaOH溶液反应的离子方程式为: 。在同温同压下,等质量铝投入足量盐酸和NaOH溶液中,产生气体的体积之比为 。
(8分)在实验室里,某同学取一小块金属钠做与水反应的实验。试完成下列问题:
(1) 切开的金属钠暴 露在空气中,最先观察到的现象是
露在空气中,最先观察到的现象是
,所发生反应的化学方程式是 。
。
(2) 将钠投入水中后,钠融化成一个小球,根据这一现象你能得出的结论是:
①,②。将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是(填编号)。
| A.有气体生成 |
| B.钠融化成小球并在液面上游动 |
| C.溶液底部有银白色的金属钙生成 |
| D.溶液变浑浊 |
(3) 在钠与水反应过程中,若生成标准状况下224mL的H2,则转移的电子的物质的量为。
(4) 根据上述实验过程中钠所发生的有关变化,试说明将金属钠保存在煤油中的目的是。
(6分)(1)0.5 mol H2O的质量为_______________,其中含有_______________个水分子,共有_______________个原子。
(2)质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是_______________;在相同温度和相同压强条件下,体积最大的是_______________,体积最小的是_______________。
(10分)已知:A、F为金属单质,D、E为 气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀。各物质间的转化关系如右图所示(部分生成物已略去):
气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀。各物质间的转化关系如右图所示(部分生成物已略去):
(1)A的原子结构示意图为 _____________________,B的化学式为_______ __________。
__________。
(2)写出反应C+I→J的离子方程式:___________________________________________。
(3)写出E+F→I的化学反应方程式为___________________________,D在E中点燃时的现象为________________________________________________________。