化学反应中既有物质变化,又有能量变化,释放或吸收热量是化学反应中能量变化的主要形式之一。已知C(石墨)、H2(g)燃烧的热化学方程式分别为:
① C(石墨)+ O2(g)=CO(g)
O2(g)=CO(g)  ="-111.0" KJ·mol-1
="-111.0" KJ·mol-1
② H2(g)+  O2(g) =H20(g)
O2(g) =H20(g)  ="-242.0" kJ·mol-1
="-242.0" kJ·mol-1
③ C(石墨)+O2(g)=CO2(g)  ="-394.0" kJ·mol-1
="-394.0" kJ·mol-1
请解答下列问题:
(1)化学反应中有能量变化的本质原因是反应过程中有 的断裂和形成。上述三个反应都是 (填“吸热”或“放热”)反应。
(2)在热化学方程式中,需要标明反应物及生成物的状态的原因是 ;在①中,02的化学计量数“1/2”是表示 (填字母)。
a.分子个数 b.物质的量 c.气体的体积
(3)反应2H20(g)=2H2(g)+02(g)的 = KJ·mol-1。
= KJ·mol-1。
(4)若C(金刚石)+02(g)=C02(g)的 ="-395.0" kJ·mol-1,则稳定性:金刚石 (填“>”、“<”或“=”)石墨。
="-395.0" kJ·mol-1,则稳定性:金刚石 (填“>”、“<”或“=”)石墨。
(5)已知形成H20(g)中的2 mol H-O键能放出926.0 kJ的能量,形成1 mol 02(g)中的共价键能放出498.0 kJ的能量,则断裂1 mol H2(g)中的H-H键需要的能量 KJ。
(6)工业制氢气的一个重要途径是用CO(g)与H2O(g)反应生成C02(g)和H2(g),则该反应的热化学方程式是 。
烯烃在一定条件下氧化时,由于C=C键断裂,转化为醛、酮,如: 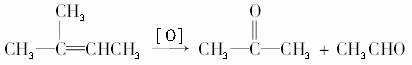
(1)若 在上述类似条件下发生反应,写出反应的方程式。______________________________________________
在上述类似条件下发生反应,写出反应的方程式。______________________________________________
(2)已知某烃(C7H12)在上述条件下反应后,生成两种有机物 ,
, ,试写出该烃的结构简式。_______________________
,试写出该烃的结构简式。_______________________
下列有机物有多个官能团: 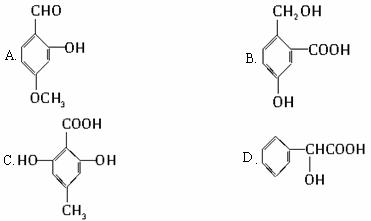
E.CH2=CHCOOCH=CHCOOCH=CH2
(1)可以看作醇类的是(填入编号)__________________。
(2)可以看作酚类的是__________________。
(3)可以看作羧酸类的是__________________。
(4)可以看作酯类的是___________________。
相同质量的钠、镁、铝分别跟足量稀硫酸反应,在同温、同压下产生气体的体积比为__________;如果这三种金属各取等物质的量,也分别跟足量稀硫酸反应,在同温同压下产生气体的体积比为_________________。
按体积比为4:2:3所组成的N2、O2、CO2,混合气体100g在标准状况下体积为___L。
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如下图。
②强度为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g。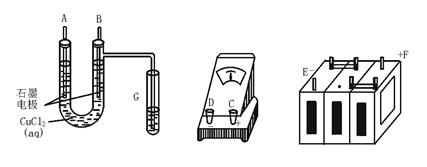
试回答:
(1)这些仪器的正确连接顺序为(用图中标注仪器接线柱的英文字母表示,下同)
E接____________,C接____________,____________接F。
实验线路中的电流方向为________→_______→________→C→________→________
(2)写出B电极上发生反应的离子方程式____________,G试管中淀粉KI溶液变化的现象为____________,相应的离子方程式是____________。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是____________。
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗 ③用蒸馏水清洗电解后电极 ④低温烘干电极后称量 ⑤低温烘干刮下的铜后称量 ⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19 C。试列出阿伏加德罗常数的计算表达式:NA=____________。