纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn+2OH-=Zn(OH)2 +2e-; Ag2O +H2O +2e- ="2Ag" +2OH-。下列说法错误的是
| A.溶液中OH-向正极移动 | B.锌发生氧化反应 |
| C.氧化银是正极 | D.在电池放电过程中,电解质溶液的碱性增强 |
若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于( )
| A.ⅢA族 | B.ⅢB族 | C.ⅠB族 | D.ⅠA族 |
元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满。若发现119号元素,请在“元素大厦”中安排好它的“房间”在( )
| A.第七周期0族 | B.第六周期第ⅡA族 |
| C.第八周期第ⅠA族 | D.第七周期第ⅦA族 |
A、B两元素为同周期ⅡA族和ⅢA族元素,若A元素的原子序数为m , 则B元素的原子序数可能为( )
①m+1②m+81③m+11④m+18⑤m+25⑥m+32
A.①③⑥B.①③⑤C.②④⑤D.①②④⑥
下列各表为周期表的一部分(表中为原子序数),其中正确的是( )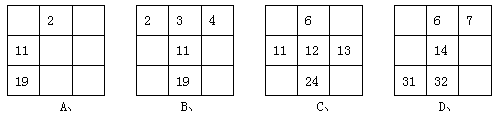
同主族两种元素原子的核外电子数的差值可能是( )
| A.6 | B.12 | C.26 | D.30 |