工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:
已知:Cu2O+2H+═Cu+Cu2++H2O
(1)固体混合物B与氢氧化钠溶液反应的化学方程式为 。
(2)滤液A中铁元素的存在形式只能为Fe2+,理由是
。涉及的离子方程式为 、
(不必书写Cu2O与盐酸的反应)。检验滤液A中Fe2+的试剂为 (填试剂名称)。
(3)将滤液C中的铝元素以沉淀形式析出,可选用的最佳试剂为 __ (填序号)。
| A.氢氧化钠溶液 | B.硫酸溶液 | C.氨水 | D.二氧化碳 |
金属E与固体F某一成分发生的反应可用于焊接钢轨,该反应的化学方程为 。
下图表示各物质之间的转化关系。已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空: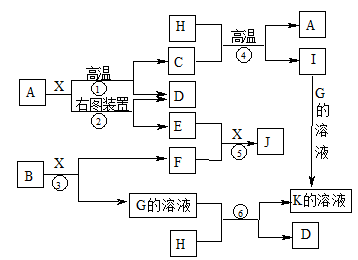
(1)写出B的电子式:____________________。
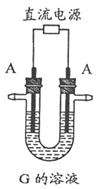
(2)反应⑤的现象是_____________________________________________。
(3)反应①的化学反应方程式是______________________________________,
在实验室引发反应④的操作是____________________________________。
(4)反应⑥的离子方程式是_________________________________________。
目前,世界上生产的镁有60%来自海水,其生产流程图如下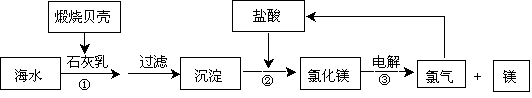
(1)贝壳的主要化学成分为。(写化学式)
(2)写出反应②的离子方程式:。
(3)写出Mg与CO2反应的化学方程式。
(4)电解氯化镁所得的氯气,除用于生产盐酸外,请举出氯气在工业上的另一种用途(用化学方程式表示)。
(原创)含氮化合物对人类生活有十分重大的意义。
(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合。
已知:N2(g)+O2(g) =2NO(g)△H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
①写出工业合成氨的热化学方程式:。
②实验室模拟合成氨,在2L密闭容器中投入1molN2 和3mol H2,容器中氨气的体积分数随时间变化如图所示。则0~10min,NH3的平均速率为;达平衡时,N2的转化率为。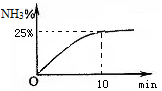
③若在②达平衡后,保持容器体积及温度不变,移走0.5molNH3,再达平衡时,N2的体积分数将,平衡常数(填“增大”“减小”或“不变”)
(2)科学家一直致力于研究常温常压下“人工固氮”的方法。据报道:在常温常压条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水反应,生成NH3和一种单质。进一步研究NH3生成量与温度关系,部分实验数据如下(反应时间3h,其余条件一样)
| T/℃ |
30 |
40 |
50 |
| NH3生成量/10-6mol |
4.8 |
5.9 |
6.0 |
①写出常温下“人工固氮”反应的化学方程式:
此反应△H0(填“>”、“<”或“=)。
②该反应中的催化剂TiO2的制取方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。写出TiCl4水解的化学方程式:
③在上述固氮过程中,除加入催化剂外,能提高生产速率,但不降低产率的措施还可以是。
A.适当升高温度 B.将氨气液化分离
C.增大反应物N2的浓度 D.增大压强
查文献知,CH3COOH、H3PO3、H3PO4三种酸所有的逐级电离常数如下:
| 酸 |
电离常数(Ka) |
酸 |
电离常数(Ka) |
| CH3COOH |
1.8×10-5 |
H3PO4 |
K1=7.11×10-3 |
| H3PO3 |
K1=3.7×10-2 |
K2=6.23×10-8 |
|
| K2=2.9×10-7 |
K3=4.5×10-13 |
用化学用语回答下列问题:
(1)上述三种酸中,酸性最强的是__________ ;
(2)常温下,在NaH2PO3稀溶液中:c(H3PO3) < c(HPO32—),则该溶液pH_______7;(填“>”“<”或“=”)
(3)等温度、等浓度的NaH2PO4溶液与Na2HPO4溶液比较,c(H3PO4)较大的是:_____;
(4)25℃时,浓度均为0.01 mol/L 的CH3COONa、Na2HPO3、Na3PO4溶液,pH最大的是:_________________;
(5)写出少量H3PO4溶液与CH3COONa溶液混合后,反应的离子方程式:_________
________________________________;
等温度、等浓度的NaH2PO3溶液与NaH2PO4溶液中,粒子间存在等量关系:c(H3PO3)+________ _____= 3c(PO43—) +_____________________—c(H+)。(用对应溶液中其它粒子浓度补充完整)
(原创)X、Y、Z、P、Q是5种原子序数依次增大的短周期元素,其中X的原子半径最小,Y、Z位于同一周期,Z、Q位于同一主族;Z原子的最外层电子数是内层电子数的3倍,X、Y能形成YX3型共价化合物,Pn+与Zn-具有相同的核外电子排布。请回答下列问题:
(1)写出下列元素符号:X __________ Q ____________
(2)写出Zn-的离子结构示意图:__________
(3)Y、Z、Q的最低价氢化物中,热稳定性最好的是:______(填化学式,下同),沸点最高的是_____
(4)由Y形成的酸HY3酸性与醋酸相似,写出其电离方程式:____________,其钠盐NaY3中各离子浓度相对大小关系:_______________
(5)P的氯化物溶液,加热蒸干并灼烧后所得固体物质为________________。
(6)由Y、P构成的化合物溶于水生成2种碱,写出该反应的化学方程式:_________________