Y元素最高正价与负价的绝对值之差为4,Y元素与M元素可形成离子化合物,该物质能溶于水并在水中电离出电子层结构相同的离子,该化合物是
| A.硫化钾 | B.硫化钠 | C.氯化钠 | D.氧化铝 |
控制适合的条件,将反应Fe3++Ag⇌Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂—硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。已知接通后观察到电流计指针向右偏转。下列判断正确的是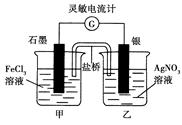
| A.盐桥中的K+移向乙烧杯 |
| B.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 |
| C.在外电路中,电子从石墨电极流向银电极 |
| D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
短周期元素A、B、C、D的原子序数依次增大,它们的核电荷数之和为32,原子最外层电子数之和为10;A与C同主族,D与B同主族,A、C原子最外层电子数之和等于B原子次外层电子数,则下列叙述正确的是
A、D元素处于元素周期表第三周期ⅥA族
B、四种元素原子半径大小顺序:A<B<C<D
C、B、D的最高价氧化物具有相似的物理性质和化学性质
D、一定条件下,B单质能置换出D单质,C单质能置换出A单质
下列图示与对应的叙述相符的是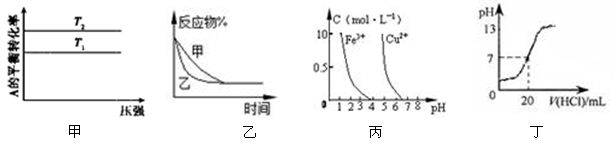
A.图甲可以判断出反应A(g) + B(g)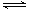 2C(g) 的△H<0,T2>T1 2C(g) 的△H<0,T2>T1 |
B.图乙表示压强对可逆反应2A(g) + 2B(g)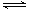 3C(g) + D(s)的影响,乙的压强比甲的压强大 3C(g) + D(s)的影响,乙的压强比甲的压强大 |
| C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4 |
| D.图丁表示25℃时,用0.1 mol·L—1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入盐酸体积的变化 |
下列关于氯水的说法正确的是
| A.向氯水中通入二氧化硫,氯水的漂白性增强 |
| B.氯水中加入NaCl固体,对溶液的pH无影响 |
| C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+ Cl-+ ClO-+H2O |
下列有关实验操作和说法正确的是
| A.用pH试纸检验气体的酸碱性时,一定要先用蒸馏水润湿 |
| B.润洗滴定管:从滴定管上口加入所要盛装的酸或碱溶液至“0”刻线,再将液体从滴定管下部放出,重复操作2~3次 |
| C.用瓷坩埚加热熔化碳酸钠固体 |
| D.Mg和Al分别为电极,插入NaOH溶液中,构成原电池,探究Mg、Al的活泼性 |