有三瓶无色溶液的标签损坏了,只知道它们分别是盐酸、BaCl2溶液和Na2CO3溶液。甲、乙两位同学各用一种试剂,一次性鉴别都取得了成功。甲用的一种指示剂是_________;乙用的一种酸溶液是__________。丙同学没用任何试剂也鉴别成功了,他的鉴别过程是:取样于试管中,编号为a、b、c,然后将三种溶液两两混合,发现a加入b中有气泡产生,a加入c中有白色沉淀产生,则a、b、c分别是________、________、__________。
高锰酸钾和二氧化锰是中学化学常用的化学试剂。根据下面相关的信息回答下列问题:
(1)已知: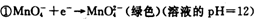
②
锰有多种化合价,如+7、十6、+4、+2价等,在中性溶液里高锰酸钾的还原产物为(填化学式)。
(2)查阅相关资料:发生如下反应(反应未配平):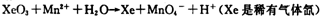
已知在高锰酸钾固体表面滴加浓盐酸,发生的半反应为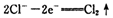
如果在盛有氯化锰溶液的试管中加入适量XeO3,振荡试管,可能观察到的现象是。
(3)已知草酸(H2C2O4)为二元弱酸,取少量草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去。
写出该反应的离子方程式。
(4)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为,MnO2的理论产量为g。
氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有__________性,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式____________________。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,配平并补充完整下列反应方程式:
______Cl2+_______Na2CO3+________=_______NaHCO3+____NaCl+____ Cl2O
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为__________。
②ClO2遇浓盐酸会生成Cl2,每生成1mol Cl2转移电子的物质的量为__________。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_________________。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2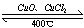 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4mol HCl被氧化放出115.6kJ的热量。
②
则断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为_________kJ,H2O中
H—O键比HC1中H—Cl键(填“强”或“弱”)__________。
某自来水厂利用河水处理成自来水的工艺流程示意图如下图所示: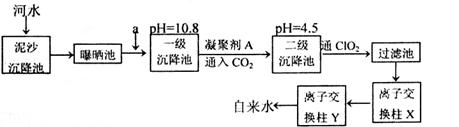
提供的试剂:饱和Na2CO3溶液、NaOH溶液、生石灰、CC14、BaCl2溶液,KOH溶液
(1)为除水中含有Ca2+、Mg2+、HCO3-、Cl-、SO42-,试剂a代表两种化学物质,主要是除去水中SO42-、Mg2+和HCO3-,这两种试剂是_______和______(只填化学式)。
(2)凝聚剂A常用FeSO4·7H2O,最终生成红褐色胶状沉淀,该胶状沉淀的化学式为______,可以除去其中的悬浮固体颗粒,该过程是______ (填序号)。
A.只有物理变化,无化学变化 B.只有化学变化,无物理变化
C.既有化学变化,又有物理变化
(3)通入CO2的目的是______和______。
(4)传统的氧化剂是Cl2,现代工艺用ClO2取代Cl2,通入CIO2的作用是______,优点是______。
(5)离子交换柱X、Y中有一种是H+型交换柱,另一种是H-型离子交换柱,目的是除去水中残留的杂质离子,则X应是哪种交换柱______(填“H+型”、“OH-型”);如果两个交换柱位置颠倒会产生什么后果____________。
能源的开发利用与人类社会的可持续性发展息息相关。
I.已知:Fe2O3(s)+3C(s)= 2Fe(s)+3CO(g) △H1="a" kJ·mol-1
CO(g)+ O2(g)=CO2(g) △H2="b" kJ·mol-1
O2(g)=CO2(g) △H2="b" kJ·mol-1
4Fe(s)+3O2(g)=2Fe2O3(s) △H3="c" kJ·mol-1
则C的燃烧热________kJ·mol-1
II.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是____(填序号)。
A.C(s)+CO2(g)=2CO(g)B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)
C.2H2O(l) = 2H2(g)+O2(g)D.2CO(g)+O2(g)=2CO2(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,请写出该原电池的负极反应:___________。
(2)某实验小组模拟工业合成氨反应N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) △H=-92.4kJ·mol-1,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中。反应前压强为P0,反应过程中压强用P表示,反应过程中 与时间t的关系如图所示。
与时间t的关系如图所示。
请回答下列问题:
①反应达平衡的标志是(填字母代号)________。
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以c(N2)变化表示的平均反应速率为________。
③若提高N2的转化率可采取的措施有________。
A.向体系中按体积比1:1再充入N2和H2
B.分离出NH3
C.升高温度
D.充入He气使压强增大
E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(CO32-)=0.2mol·L-1,如果加入等体积的Na2SO4溶液,若要产生 BaSO4沉淀,加入Na2SO4溶液的物质的量浓度最小是________mol • L-1。
芳香烃A是一种重要的存机化工原料,相对分子质量为92。A在一定条件下可发生如下转化(部分产物及反应条件略去)。
已知:
请回答:
(1)A的化学名称为_______G的结构简式为______。
(2)B的核磁共振氢谱有______个吸收峰,③的反应类型为______。
(3)⑤的化学方程式为,
阿司匹林与足量氢氧化钠溶液反应的化学方程式为。
(4)符合下列条件的E的同分异构体共有种,任写出其中一种的结构简式。
i.能发生银镜反应但不能水解
ii.1 mol同分异构体最多消粍2 mol NaOH