某同学进行硫酸铜晶体结晶水含量的测定实验。完成下列填空:
【实验步骤】
(1)用_______(填仪器名称,下同)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入约2 g研细的硫酸铜晶体,并称量。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至____________中冷却到室温,并称量。
(4)重复(3)的实验进行恒重操作,直至两次称量结果相差不超过0.001 g。
【数据记录与处理】
| |
第一次实验 |
第二次实验 |
| 坩埚的质量(g) |
29.563 |
30.064 |
| 坩埚+试样的质量(g) |
31.676 |
32.051 |
| 恒重后,坩埚+硫酸铜的质量(g) |
30.911 |
31.324 |
| x的值 |
5.05 |
5.13 |
根据上表中的数据处理结果,计算本次实验的相对误差为______%(已知x的理论值为5)。
【分析与讨论】
(1)做一次实验,至少需要加热________次(填数字,下同);至少需要称量_________次。
(2)恒重操作的目的是__________________。
(3)重复两次实验求x平均值的目的是_____________________________。
(4)实验值比理论值偏大的原因可能是________(填编号)。
a.加热过程中有晶体溅出 b.被测样品中含有加热不挥发的杂质
c.实验前,晶体表面潮湿 d.晶体灼烧后直接放在空气中冷却
(14分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c..浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含少量的H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是。
(4)认为气体Y中 还含有Q的理由是(用化学方程式表示)。
还含有Q的理由是(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于(选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是。
(11分)设计一个简单的一次性完成实验的装置图,目的是验证醋酸溶液,二氧化碳水溶液、苯酚溶液的酸性强弱顺序。
①利用上图所示的仪器可以组装实验装置,则仪器的连接顺序为:
接_____ , 接______ ,接(填字母)
②写出装置I和II中的实验现象:
I中_______________ II中_____________________
③写出装置II中发生反应的方程式
④由强到弱排序三者的酸性顺序
材料1.某温度时,在2L密闭容器中有X、Y、Z三种气态物质。实验测得不同时刻各物质的量如下表所示,同时测得至3min时吸收热量75kJ。
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
1.00 |
0.00 |
| 3 |
0.75 |
0.50 |
0.50 |
| 5 |
0.65 |
0.30 |
0.70 |
| 9 |
0.60 |
0.20 |
0.80 |
| 14 |
0.60 |
0.20 |
0.80 |
(1)写出该反应的热化学反应方程式:。
(2)该温度下反应的平衡常数K=。
(3)若该反应的逆反应速率与时间的关系如上图所示,则:
① t2~t3时平衡向(填“正”或“逆”)反应方向移动。
②t4时被改变的外界条件是(选择一个正确选项)
| A.升温 | B.降温 | C.降压 | D.移去部分反应物 E.加入负催化剂 |
材料2.另有实验,利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
| 实验 编号 |
温度/K |
盐酸浓度 /mol·L-1 |
醋酸浓度/mol·L-1 |
实验目的 |
| ① |
298 |
0.20 |
a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
|
| ② |
308 |
0.20 |
||
| ③ |
298 |
0.40 |
||
| ④ |
0.20 |
0.20 |
||
| ⑤ |
(4)请完成上工作表(填写实验④⑤的空格)。
(5)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系图如图。
Ⅰ. 假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是。
Ⅱ.若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
在20.0 mL 0.10 mol·L-1的盐酸溶液中滴加0.10mol·L-1 NaOH溶液,并以酚酞为指示剂。
(1)填写下表中的空格(结果保留一位小数)。
| ①V(NaOH)(mL) |
0.00 |
18.00 |
19.80 |
19.96 |
19.98 |
20.00 |
20.02 |
20.04 |
20.20 |
| ②溶液的pH |
1.0 |
2.3 |
3.3 |
4.3 |
7 |
9.7 |
10.7 |
(2)根据上表中的数据,画出滴定过程中溶液的pH与加入NaOH溶液体积的关系示意
图,并指出该滴定曲线的特点。
(3)一般中和滴定操作要求误差≤0.1%,其关键之一是选择合适的指示剂来确定终点。你认为能否用甲基橙作上述反应的指示剂,说明理由。
(4)其实滴定的方法有多种,除上述实验中的酸碱中和滴定外,还有沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂和被滴定物的生成物的溶解度要比滴定剂和指示剂生成物的溶解度________(填“大”、“小”或“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更______溶的缘故。
某活动小组利用下图装置验证NO的还原性及探究工业生产硝酸的原理。(装置气密性已检查完毕)。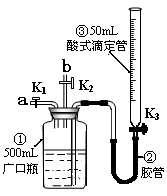
(1)向广口瓶①中通入NO并测定NO的体积
①通入NO前,向广口瓶①中加入水的主要操作:;
②从导管a通入一定量的NO,并记录滴定管读数,求出液面变化的数值为VL(V<50mL,气体体积已换算为标准状况)。准确测定NO的体积的主要操作:;
(2)验证NO的还原性;探究工业生产硝酸的原理
①、停止通入NO后关闭K1、K3,打开K2,从导管b缓缓通入O2,可观察到的现象是,写出对应现象的化学反应方程式、;
②、继续通入O2,打开K3并及时调整滴定管③液面与广口瓶①中液面相平,直至广口瓶①中刚好充满液体。
i当通入氧气的体积为1/2V时,则广口瓶①的气体体积为;
ii 当广口瓶①中刚好充满液体时,所得溶液的物质的量浓度为mol/L。