2013年6月,我国“蛟龙”号再次刷新“中国深度”——下潜7062米,为我国深海矿物资源的开发奠定了基础。海洋深处有丰富的锰结核矿,锰结核的主要成分是MnO2,同时还含有黄铜矿。
Ⅰ、“蛟龙”号外壳是用特殊的钛合金材料制成,它可以在7000m的深海中承受重压,Ti是以钛白粉(TiO2)为原料进行生产,钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为____________________________。
Ⅱ、MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示:
(1)步骤Ⅱ中以NaClO3为氧化剂,当生成0.05molMnO2时,消耗0.1mol/L的NaClO3溶液200ml,该反应离子方程式为_______________________________。
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是____________。
Ⅲ、利用黄铜矿炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)可制备Fe2O3,方法为:
(A)用过量的稀盐酸浸取炉渣、过滤;(B)向滤液中加入5%的H2O2,再向其中加入过量的NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得到Fe2O3。根据以上信息回答下列问题:
(1)(B)中向滤液中加入5%的H2O2,其目的是_________________________________。
(2)设计实验证明炉渣中含有FeO___________________________________________。
(3)将煅烧得到的Fe2O3还原为Fe单质,再将质量为m g的Fe单质分成相等的四份,分别与50mL、100mL、150mL、200mL的等浓度的稀硝酸反应,反应产物NO在标况下的体积见附表:
| 实验 |
① |
② |
③ |
④ |
| V(HNO3)/ml |
50 |
100 |
150 |
200 |
| V(NO)/L |
1.344 |
2.688 |
3.36 |
3.36 |
则:①m=________g。
②写出实验②发生反应的化学方程式:_____________________________。
在没有现成的CO2气体发生器的情况下,请你选用下图所示部分仪器,装配成一个简易的、能随开随用、随关随停的CO2气体发生装置。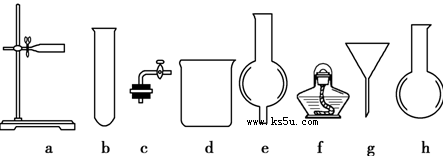
(1)应选用的仪器是________________(填入编号);
(2)若用上述装置制取CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状纯碱、块状大理石,比较合理的方案,应选用的药品是_________________。
(1)某研究性学习小组为了证明铁的金属性比铜强,他们设计了如下几种方案,其中合理的是________(填序号)。
A.铁片置于硫酸铜溶液中置换出铜
B.铁、铜与氯气反应分别生成FeCl3、CuCl2
C.铜片置于FeCl3溶液中,铜片逐渐溶解
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡
E.常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属活动性比铜强的实验。要求:
A.此方案的原理不同于上述任一合理方案;
B.绘出实验装置图并注明所需的药品;
C.写出实验过程中的主要实验现象。
实验装置实验现象______________。
下列装置为中学化学实验常用的气体制备装置


A B C
(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置 。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置 。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置。
(4)①某研究性小组查阅资料得知,漂白粉与硫酸溶液反应可制的氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4="2" CaSO4+2 Cl2+2H2O应选择装置。
②为证明氯气具有氧化性将氯气分别通入到亚硫酸钠溶液和氯化亚铁溶液中,设计实验证明亚硫酸钠已经被氧化 。
写出氯气和氯化亚铁溶液反应的离子方程式:。
③请写出氯气尾气处理的离子方程式 。
如图所示,把试管放入盛有25 ℃的饱和澄清石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中,试回答下列问题:
Ⅰ.(1)实验中观察到的现象是
________________________________________________________________________
________________________________________________________________________
(2)产生上述现象的原因是
________________________________________________________________________
________________________________________________________________________
(3)写出有关反应的离子方程式
________________________________________________________________________
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
Ⅱ.已知断开1mol H—H键,1mol N—H键、1 molNN键分别需要吸收的能量为436kJ、391kJ、946kJ。一定条件下由氢气和氮气反应生成1mol NH3需要________(填“放出”或“吸收”)________kJ的热量。
下图是某学生设计的实验室制备干燥Cl2及吸收多余氯气的实验装置图,请回答:
(1)指出上述图中的各处错误:
①_________________________________________________________;
②_________________________________________________________;
③_________________________________________________________;
④________________________________________________________。
(2)在改过后的装置中,下列物质的作用分别是:
①饱和食盐水_________________________________________;
②浓硫酸____________________________________________;
③NaOH溶液_________________________________________。