(2014届江苏省如东县高三上学期期末四校联考化学试卷)
草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示

①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2︰1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)上图实验装置中仪器乙的名称为:________________________。装置B的作用是 。
(2)检验淀粉是否水解完全的方法:______________________________________________。实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:____________________________________________________。
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;

由此你认为溶液褪色总是先慢后快的原因是_________________________________________。
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4·7H2O 固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解。向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置。倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干。
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是 。
②用丙酮洗涤固体两次的目的是 。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为 ;操作II,在溶液中用硫酸酸化至pH=2的目的是 。
(2)操作IV的顺序依次为: 、 、过滤、洗涤、干燥。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② 。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。滴定时发生反应的离子方程式为:5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)。
①用硫酸酸化的0.01000 mol/LKMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。
②判断此滴定实验达到终点的方法是 。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 。
实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。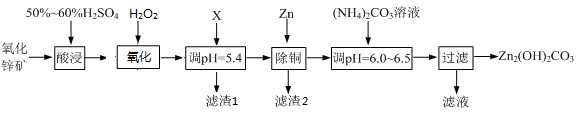
(1)“酸浸”时保持H2SO4过量的目的是 。
(2)写出氧化时的离子方程式: ;
(3)流程中调节pH=5.4所加试剂X为 (填序号)。
A.NaOH B.ZnOC.ZnCO3
滤渣1的成分为 (写化学式)
(4)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为 (填化学式)。
(5)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为 。
某学校化学课外活动小组的同学用粗铜(含杂质铁)按如下流程回收氧化铜晶体(CuCl2·2H2O)等相关物质。请回答下列问题:
已知Cu2+、Fe3+沉淀时的相关PH:
| 氢氧化物开始沉淀时的pH |
氢氧化物完全沉淀时的pH |
|
| Cu2+ |
4.7 |
6.7 |
| Fe3+ |
1.9 |
3.2 |
(1)为得到固体I.同学们设计下图装置:
①添加药品之前,如何检查装置A的气密性________________。
②整套装置有不足之处,要完成实验必须改进的是__________________。
③装置D的作用是__________________(用离子方程式表示)。
(2)操作Ⅱ和操作Ⅴ相同,其中所需的主要玻璃仪器有烧杯______、_______。
(3)试剂X用于调节pH以除去杂质。
①试剂X可以是_________(填字母序号)。
a.NaOHb.Cu(OH)2c.Na2CO3d.CuO
②为使CuCl2溶液中的Fe3+完全除去,溶液pH范围应保持在______,当溶液的pH=4时,c(Fe3+)=_____。[Fe(OH)3的KSP=4.0×10-38]
(4)由溶液Ⅳ欲获得氯化铜晶体(CuCl2•2H2O),应采取的措施是________。
(5)由溶液Ⅳ获得 CuCl2·2H2O晶体过程中,有同学发现溶液颜色由蓝色变为绿色进而变成黄绿色,经查阅资料发现氯化铜溶液中存在以下平衡关系: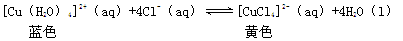
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中不能证明CuCl2溶液中有上述转化关系的是___(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.0kJ/mol
CO(g)+3H2(g) △H1=+206.0kJ/mol
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图1所示。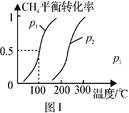
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:
CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol CO(g)和2mol H2(g),发生反应(ii),反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图2所示。
①反应(ii)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,
原因是 (用化学方程式表示)。
③在500℃恒压条件下,请在图2中画出反应体系中n(CH3OH)随时间t变化的总趋势图。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:
CH3OH(g)+CO(g) HCOOCH3(g)
HCOOCH3(g) 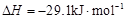 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 (填“3.5×106Pa”、“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是 。
拉氧头孢钠是一种抗生素,合成拉氧头孢钠中间体G的路线如下(部分反应物、反应条件略去):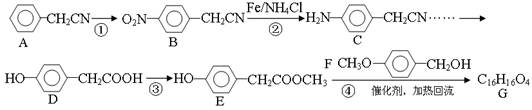
(1)A与浓硝酸发生反应①的条件是__________,反应②的反应类型是______________;
(2)F分子中官能团的名称是______________________;
(3)写出反应③的化学方程式____________________________;.
(4)D的同分异构体有多种,写出一种符合下列条件的异构体M的结构简式_______________;
Ⅰ.苯环上一氯代物只有两种;Ⅱ.遇氯化铁溶液不变色;Ⅲ.1molM最多能与2molNaOH反应;Ⅵ.核磁共振氢谱只有4个峰。
(5)已知:①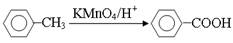 ;
;
②当苯环上已有一个“−CH3”或“−Cl”时,新引入的取代基一般在它的邻位或对位;当苯环上已有一个“−NO2”或“−COOH”时,新引入的取代基一般在它的间位。
请写出以甲苯、乙醇为原料制备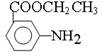 的合成路线图(无机试剂任用)。
的合成路线图(无机试剂任用)。