拉氧头孢钠是一种抗生素,合成拉氧头孢钠中间体G的路线如下(部分反应物、反应条件略去):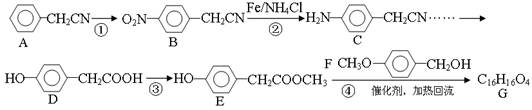
(1)A与浓硝酸发生反应①的条件是__________,反应②的反应类型是______________;
(2)F分子中官能团的名称是______________________;
(3)写出反应③的化学方程式____________________________;.
(4)D的同分异构体有多种,写出一种符合下列条件的异构体M的结构简式_______________;
Ⅰ.苯环上一氯代物只有两种;Ⅱ.遇氯化铁溶液不变色;Ⅲ.1molM最多能与2molNaOH反应;Ⅵ.核磁共振氢谱只有4个峰。
(5)已知:①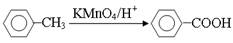 ;
;
②当苯环上已有一个“−CH3”或“−Cl”时,新引入的取代基一般在它的邻位或对位;当苯环上已有一个“−NO2”或“−COOH”时,新引入的取代基一般在它的间位。
请写出以甲苯、乙醇为原料制备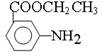 的合成路线图(无机试剂任用)。
的合成路线图(无机试剂任用)。
化学兴趣小组对用铜制取硫酸铜晶体的实验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中置一些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
(1)甲组实验可用一个化学反应方程式表示为,使反应变快的可能原因是。
(2)在五个方案中,科学性有错的是组方案,经济性最差的是组方案。
(3)可持续发展的原则要求化工生产①能耗尽量低,这应排除使用组方案;②无污染,这应排除组方案。
(4)相对能耗低,污染小的是组方案。该给从反应器中排出的溶液中(含有少量H2SO4以抑制水解)取得产品的实验操作步骤应为、、,对取得产品后残留物质的处理方法是。
Ⅰ.玻璃棒是中学化学实验室中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是
(填写编号)
①用pH试纸测定Na2CO3溶液的pH ②配制一定物质的量浓度的氯化钠溶液③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体④探究Ba(OH)2 8H20晶体和NH4Cl晶体反应过程中的能量变化⑤用蒸馏法分离两种沸点差距较大的液体⑥过滤分离互不相溶的固体和液体⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程⑧稀释浓H2SO4的过程
8H20晶体和NH4Cl晶体反应过程中的能量变化⑤用蒸馏法分离两种沸点差距较大的液体⑥过滤分离互不相溶的固体和液体⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程⑧稀释浓H2SO4的过程
Ⅱ.为测定某含有杂质Na2O的Na2O2样品的纯度,某小组同学分别设计了如下方案。
【方案一】准确称量样品mg,与水充分反应后将溶液的体积稀释为VmL,从中取出V1mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量。
⑴此方案中,酸碱中和滴定时应选用滴定管。
⑵写出此方案中涉及到的反应的离子方程式。
【方案二】准确称量样品mg,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量。
⑶该方案的实验过程中,仪器的连接顺序是(填仪器下方序号),①中的进气口为(填“A”或“B”)
⑷装置⑤的作用是。
⑸你认为方案一、方案二中测定结果比较准确的是。
.(8分)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。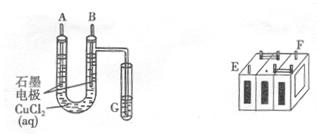
(1)若A接E,B接F,而B电极出现,反应式为,则说明F为正极;
(2)某学生试图用上述装置,根据电极上析出的物质的质量来测定阿伏加德常数的值。通电时间t s,测定通过电路的电流强度为I。精确测得A电极析出铜的质量的操作包括以下几步:
①低温烘干电极后称量
②用蒸馏水清洗电解后的电极
③称量电解前的电极质量
④再次低温烘干后称量
正确的操作顺序是;
(3)若经过上述操作测定生成铜的质量为mg,试列出计算阿伏加德罗常数的表达式(已知一个电子电量为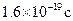 ):
): =
=
.(8分)设计实验证明弱酸的酸性:醋酸>碳酸>硼酸。提供的试剂有: 溶液、
溶液、 溶液、
溶液、 溶液、硼酸(
溶液、硼酸(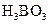 )溶液、
)溶液、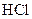 溶液、
溶液、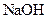 溶液。
溶液。
(1)证明酸性醋酸>碳酸的操作方法是(简述):,化学方程式是。
(2)证明酸性:碳酸>硼酸的操作方法是(简述):,得出“酸性碳酸>硼酸”的结论的现象或理由是(简述)。
为测定碳酸钙的纯度(设含杂质SiO2),某兴趣小组的同学设计了如下几个实验方案:
方案Ⅰ
①称取碳酸钙样品M g
②用c1mol/L的盐酸V1 mL(过量)溶解样品
③取溶解后的溶液体积的十分之一,用c2 mol/L的NaOH溶液滴定,恰用去V2 mL。
方案Ⅱ
①称取碳酸钙样品M g
②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为M1 g
方案Ⅲ
①称取碳酸钙样品M g
②加入足量c mol/L的盐酸V mL使之完全溶解
③过滤并取滤液
④在滤液中加入过量c1 mol/L的Na2CO3溶液V1 mL
⑤将步骤④中的沉淀滤出、洗涤、干燥、称重,质量为M1 g。
根据以上实验方案,回答以下问题:
(1)方案Ⅰ中计算碳酸钙纯度的的公式为_________________________________。
(2)方案Ⅱ中的“冷却”应如何操作?________________;理由是_______________________。
(3)方案Ⅲ中不需要的数据是_____________(填选项编号)。
A.c、V B.c1、V1C.M1 D.M
(4)方案Ⅲ中为了减少实验误差,必要的操作是_______________(填选项编号)。
A.精确测定Na2CO3溶液的体积V1 mL
B.精确配制Na2CO3溶液,使其浓度为c1 mol/L
C.将步骤③所得沉淀洗涤,洗涤液并入④中
(5)请再设计一个实验方案:________________________________。