有人设计了如右图所示的实验装置,目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物是什么。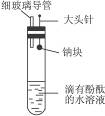
(1)当进行适当操作时还需要的仪器有_________________________________;
(2)如何进行操作?_____________________________________________________________;
(3)实验现象是________________________________________________________________。
实验室中利用下图所示装置制备纳米碳酸钙(1纳米=1×10-9m)(部分夹持装置已略去),向饱和CaCl2溶液中通入NH3和CO2可制得纳米碳酸钙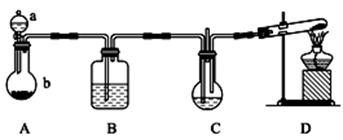
供选择的药品:①石灰石 ②氯化铵 ③氢氧化钙 ④饱和氯化钙溶液 ⑤浓硫酸
⑥6 mol·L-1盐酸 ⑦饱和食盐水 ⑧饱和NaHCO3溶液
(1)装置A中,仪器a的名称是,仪器b中应盛放的固体为。(填药品序号)。装置B 中盛放的溶液是(填药品序号)。装置D的试管中发生反应的化学方程式为。
(2)如何判断所得碳酸钙颗粒是否为纳米级。。
(3)通入适量气体后,C装置中物质恰好完全反应,过滤,所得滤液显(填“酸”、“碱”、“中”之一)性。
(4)装置C中, 右边的导管并未插入液面,原因是
(5)上述装置存在一处缺陷,该缺陷为。
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9. 7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为。
(3)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为。
A.氯水 B.KSCN溶液C.NaOH溶液 D.酸性KMnO4溶液
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
则溶液中铁元素的总含量为g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将
会(填“偏高” “偏低” “不变”)
亚氯酸钠(NaClO2 )是一种高效漂白剂和强氧化剂。某兴趣小组以NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如下:
回答下列问题:
(1)用NaOH固体配制约20%的NaOH溶液100mL,需要的仪器有烧杯、玻璃棒、、。
(2)实验须使NaClO3稍微过量,目的是。
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意。
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2—,则另一种为。
(5)B中反应的离子方程式为。
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入(填序号,下同)酸化,再加入检验。
①稀HNO3
②稀H2SO4
③K2SO3溶液
④BaCl2溶液
⑤FeCl2溶液
⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9 g NaClO2·3H2O(式量:144.5),至少需g NaClO3(式量:106.5)。
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。
方法一铜粉还原CuSO4溶液
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+ 2Cl- [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)将废铜板浸入热的H2SO4溶液中,并通入空气,可以生成CuSO4。该反应的离子方程式为。
(2)①中,“加热”的目的是,当观察到现象,即表明反应已经完全。
(3)②中,加入大量水的作用是。
(4)潮湿的CuCl在空气中易发生水解和氧化。上述流程中,为防止水解和氧化所添加的试剂或采取的操作是。
方法二铜电极电解饱和食盐水(实验装置如图)
(5)阳极的电极反应式为。
(6)实验开始时,阳极附近没有产生CuOH沉淀的原因是。
(已知:Ksp(CuCl)=1.2×10-6,Ksp(CuOH)=1.2×10-14)
(1 5分)无水氯化铝是有机化工常用的催化剂,氯化铝178℃时升华,极易潮解,遇水发热并产生白色烟雾。氯化铝还易溶于乙醇、氯仿和四氯化碳。
实验室可用反应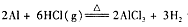 制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
制备少量无水氯化铝,某同学利用该原理设计如下实验装置: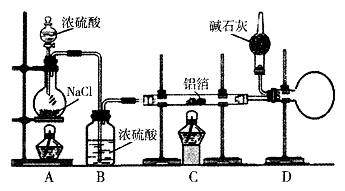
(1)A烧瓶中发生反应的化学方程式:
(2)以下三步操作的先后顺序为(填序号)。
①点燃A处酒精灯
②点燃C处酒精灯
③滴加A处浓硫酸
(3)D中干燥管内碱石灰的作用是。
(4)下列有关AICl3的说法合理的是(填序号)。
①AlCl3水溶液能导电
②熔融态AlCl3能导电
③镁条能置换出AlCl3溶液中的Al
(5)实验室也可通过反应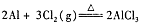 制备无水氯化铝,此法若还利用上述装置,在A烧瓶中增用Mn02。固体之外,还必须对装置进行的改动是。
制备无水氯化铝,此法若还利用上述装置,在A烧瓶中增用Mn02。固体之外,还必须对装置进行的改动是。
(6)指出该实验装置可能存在的一种安全隐患:。