CuCl是应用广泛的有机合成催化剂,可采取不同方法制取。
方法一 铜粉还原CuSO4溶液
已知:CuCl难溶于水和乙醇,在水溶液中存在平衡:CuCl(白色)+ 2Cl- [CuCl3]2-(无色溶液)。
[CuCl3]2-(无色溶液)。
(1)将废铜板浸入热的H2SO4溶液中,并通入空气,可以生成CuSO4。该反应的离子方程式为 。
(2)①中,“加热”的目的是 ,当观察到 现象,即表明反应已经完全。
(3)②中,加入大量水的作用是 。
(4)潮湿的CuCl在空气中易发生水解和氧化。上述流程中,为防止水解和氧化所添加的试剂或采取的操作是 。
方法二 铜电极电解饱和食盐水(实验装置如图)
(5)阳极的电极反应式为 。
(6)实验开始时,阳极附近没有产生CuOH沉淀的原因是 。
(已知:Ksp(CuCl)=1.2×10-6,Ksp(CuOH)=1.2×10-14)
【原创】(15分)二氯化一氯五氨合钴([Co(NH3)5Cl]Cl2,M=250.5g·mol-1,紫红色固体)因在离子鉴定、电镀、医学方面的广泛应用受到人们的关注,它不溶于乙醇,难溶于水。实验室制备二氯化一氯五氨合钴的流程及装置如下:
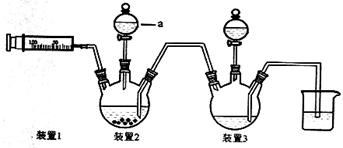
相关信息如下:Co + 2HCl ="=" CoCl2 + H2↑
[Co(NH3)5Cl]2++H2O [Co(NH3)5H2O]3+(深红色)+Cl-
[Co(NH3)5H2O]3+(深红色)+Cl-
请回答下列问题:
(1)写出仪器a的名称 ;向装置2中加入适量盐酸后,关闭活塞进行第①步反应,如何通过装置1判断该反应已经完全 ;在不添加其他试剂的前提下,如何操作能够实现第②步反应 。
(2)第③步加入双氧水的作用是 ;第④步加入适量浓盐酸的作用是 。
(3)第⑥步洗涤操作为:先用冷水洗涤,再用乙醇洗涤。其中乙醇洗涤的目的是 。
(4)第⑦步烘干操作的温度应控制在100-160℃,温度不能过低也不能过高的可能原因是 。
(5)将产品分为10等份,取其中一份于强碱溶液中,加热煮沸,蒸出所有氨气后,向溶液中加酸中和,然后加入0.5000mol·L-1的KI溶液0.04000L(过量),滴加指示剂,用0.1000mol·L-1Na2S2O3溶液滴定,达到终点消耗0.1200LNa2S2O3标准溶液,则该实验产率为 。(2Co3++2I-=2Co2++I2;2S2O32-+I2=S4O62-+2I-)
【命题立意】本题基于实验室制备二氯化一氯五氨合钴,融入工艺流程、实验原理分析、实验基本操作、条件控制、产率计算等内容,旨在考查考生知识迁移能力、综合实验能力和实验探究能力。
【改编】(15分)硫代硫酸钠俗称“海波”,又名“大苏打”,具有较强的还原性和配位能力,是冲洗照相底片的定影剂,棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图(a)所示。
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示。
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式 。装置B、D的作用是 。
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH 时,打开K2、关闭K1并停止加热;C中溶液要控制pH的理由是 。
步骤4:过滤C中的混合液,将滤液经过 、 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42—全部转化为Cr2O72—;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L—1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:
①Cr2O72— + 6I—+ 14H+ ="=" 2Cr3+ + 3I2 + 7H2O;
②I2 + 2S2O32— ="=" 2I—+ S4O62—
则该废水中Ba2+的物质的量浓度为 。
(15分)过渡金属的单质及化合物很多有催化性能,氯化铜、氯化亚铜经常用作有机合成催化剂。实验室中用氯气与粗铜(杂质只有Fe)反应,制备铜的氯化物的流程如下。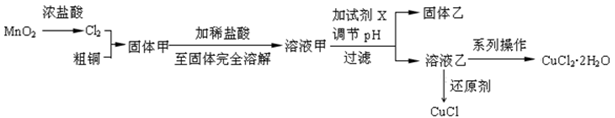
查阅资料:
氯化亚铜:白色微溶于水,在干燥空气中稳定,受潮则易变蓝到棕色,在热水中迅速水解生成氧化铜水合物而呈红色。
氯化铜:从水溶液中结晶时,在26~42℃得到二水物,在15℃以下得到四水物,在15~25.7℃得到三水物,在42℃以上得到一水物,在100℃得到无水物。
(1)现用如图所示的实验仪器及药品制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
①按气流方向连接各仪器接口顺序是:a→ 、 → h 、i → 、 → 。
②本套装置有两个仪器需要加热,加热的顺序为先 后 ,这样做的目的是 。
(2)析流程:
①固体甲需要加稀盐酸溶解,其理由是 ;
②溶液甲可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号) 。
a.NaOH b. NH3·H2O c.CuOd.CuSO4
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、 、 、洗涤、干燥。
(3)向溶液乙中加入适当的还原剂(如SO2、N2H4、SnCl2等),并微热得到CuCl沉淀,写出向乙溶液加入N2H4(氧化产物为无毒气体)的离子方程式 。此反应只能微热的原因是 。
(4)若开始取100g 含铜96%的粗铜与足量Cl2反应,经上述流程只制备CuCl2·2H2O,最终得到干燥产品277g,求制备CuCl2·2H2O的产率 (精确到1%);分析出现此情况的主要原因 。
氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是___ 。
(2)实验室用MnO2与浓盐酸反应制取氯气的过程中,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a.KI溶液 b.FeCl2溶液 c.KCl溶液
写出你选择的一种吸收试剂与Cl2反应的离子方程式:____ 。
也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是____ 。
(3)以粗盐为原料制备亚氯酸钠(NaClO2)的工艺流程如下
写出二氧化氯发生器中生成二氧化氯的离子方程式 。
(4)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
a.检验装置的气密性;
b.通入干燥的Cl2,赶尽装置中的空气;
c.用酒精灯在铁屑下方加热至反应完成;
d.在沉积的FeCl3固体下方加热
e.体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
①装置D中FeCl2的作用是 ,写出检验FeCl3的离子方程式 。
②画出尾气吸收装置E并注明试剂。
③该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,FeCl3与H2S反应的离子方程式为________________ 。
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率__ _.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.