某学校化学课外活动小组的同学用粗铜(含杂质铁)按如下流程回收氧化铜晶体(CuCl2·2H2O)等相关物质。请回答下列问题:

已知Cu2+、Fe3+沉淀时的相关PH:
| |
氢氧化物开始沉淀时的pH |
氢氧化物完全沉淀时的pH |
| Cu2+ |
4.7 |
6.7 |
| Fe3+ |
1.9 |
3.2 |
(1)为得到固体I.同学们设计下图装置:

①添加药品之前,如何检查装置A的气密性________________。
②整套装置有不足之处,要完成实验必须改进的是__________________。
③装置D的作用是__________________(用离子方程式表示)。
(2)操作Ⅱ和操作Ⅴ相同,其中所需的主要玻璃仪器有烧杯______、_______。
(3)试剂X用于调节pH以除去杂质。
①试剂X可以是_________(填字母序号)。
a.NaOH b.Cu(OH)2 c.Na2CO3 d.CuO
②为使CuCl2溶液中的Fe3+完全除去,溶液pH范围应保持在______,当溶液的pH=4时,c(Fe3+)=_____。[Fe(OH)3的KSP=4.0×10-38]
(4)由溶液Ⅳ欲获得氯化铜晶体(CuCl2•2H2O),应采取的措施是________。
(5)由溶液Ⅳ获得 CuCl2·2H2O晶体过程中,有同学发现溶液颜色由蓝色变为绿色进而变成黄绿色,经查阅资料发现氯化铜溶液中存在以下平衡关系:
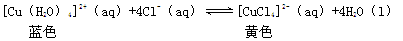
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中不能证明CuCl2溶液中有上述转化关系的是___(填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
实验室用2.0 mol/L NaCl溶液配制100mL 0.50 mol/L NaCl溶液。
(1)配制上述溶液,需要2.0 mol/L NaCl溶液mL。
(2)配制上述溶液除需要玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、量筒、 __________________。20g NaOH固体溶解 后配制成100mL溶液,其溶质物质的量为,取出10mL该溶液,它的物质的量浓度为。
(3)在配制过程中,其它操作都正确,下列操作中,能引起浓度偏高的有(填代号): ①
②定容时加蒸馏水超过刻度线,又用胶头滴管吸出
②转移溶液前,容量瓶中含有少量 水
③定容摇匀后发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线
实验室用浓盐酸和二氧化锰共热制取氯气,现要制取一瓶干燥纯净的氯气,并防止剩余氯气逸出污染空气。现有下列仪器和药品可供使用:
(1)写出实验室用浓盐酸和二氧化锰制取氯气的化学反应方程式:【二氧化锰转变为氯化锰】;
(2)连接上述仪器的正确顺序是(填各接口处的字母)
A接,接,接G, H接D。
(3)气体尾气吸收装置中反应的化学方程式为。
(4)在装置中:a.饱和食盐水的作用是;
b.浓硫酸的作用是;
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时必需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
【甲方案】如下图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
(1)洗气瓶C中导管末端连接一个多孔球泡D,其目的是______________________________。
(2)洗气瓶C中的溶液还可以用其他试剂代替,如酸性高锰酸钾溶液,你认为选择酸性高锰酸钾溶液的理由有________________________________________________________。
(3)洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量____________(填“偏高”、“偏低”或“无影响”)。若某实验小组同学测得的SO2含量总是偏低,可能的原因是__________________________________________________。(假设实验装置、测量仪器、药品和实验操作程序均合理)
【乙方案】:实验步骤如下面流程图所示:
(4)写出步骤②中反应的化学方程式____________________________________________。
(5)步骤③中判断沉淀已经洗涤干净的方法是_______________________________________。
(6)实验中若通过的尾气体积为33.6L (已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该尾气中二氧化硫的含量是否达到排放标准(写出计算过程)。
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证 卤族元素性质的递变规律。图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
(1)甲同学设计实验的依据是_____________________________________________;
写出选用物质的名称:A____________,B__________,C____________;
(2)甲同学设计的实验中所涉及反应的离子方程式分别为___________________________________________________;
________________________________________________________________________。
(3)乙同学的实验原理是______________________________________________。
写出B处的离子方程式: ___________________________________________________。
今欲用NaOH固体配制500mL 0.2mol/L的NaOH溶液。根据题意填空:
(1)配制该溶液应选用mL容量瓶。
(2)称量时将NaOH放在__________中,用托盘天平称取g。
(3)若实验时遇到下列情况,将会使所配的溶液浓度发生什么变化(填“偏高”、“偏低”或“无影响”):
A.加水定容时超过刻度线 ;
B.没有将洗涤液转入容量瓶中;
C.容量瓶内壁沾有水滴没有烘干就进行配制;
D.定容时俯视;
(4)选择下列实验方法分离物质,将分离方法的序号填在横线上
A.过滤 B.渗析 C.蒸发结晶 D.蒸馏
①______分离饱和食盐水与沙子的混合物。
②______从硝酸钾和氯化钠的混合液中获得硝酸钾。