今欲用NaOH固体配制500mL 0.2mol/L的NaOH溶液。根据题意填空:
(1)配制该溶液应选用 mL容量瓶。
(2)称量时将NaOH放在__________中,用托盘天平称取 g。
(3)若实验时遇到下列情况,将会使所配的溶液浓度发生什么变化(填“偏高”、“偏低”或“无影响”):
A.加水定容时超过刻度线 ;
B.没有将洗涤液转入容量瓶中 ;
C.容量瓶内壁沾有水滴没有烘干就进行配制 ;
D.定容时俯视 ;
(4)选择下列实验方法分离物质,将分离方法的序号填在横线上
A.过滤 B.渗析 C.蒸发结晶 D.蒸馏
①______分离饱和食盐水与沙子的混合物。
②______从硝酸钾和氯化钠的混合液中获得硝酸钾。
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0 ,与反应前的体积相比,反应后体积缩小的百分率是()
| A. | 16.7 | B. | 20.0 |
| C. | 80.0 | D. | 83.3 |
水蒸气通过灼热的焦炭后,流出气体一的主要成分是
和
,还有
和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有
和
。(加热装置和导管等在图中略去)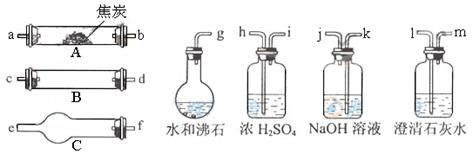
回答下列问题:
(1)盛浓
的装置用途是。
盛 溶液的装置用途是。(2)仪器B中需加入试剂的名称(或化学式)是:。
所发生反应的化学方程式是:。
(3)仪器C中需加入试剂的名称(或化学式)是:。
其目的是。
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:
。
(5)能证明混合气体中含
的依据是。能证明混合气体中含
的依据是。
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作
用是:。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
| A |
3 mL乙醇、2 mL乙酸、1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
5.0 |
| B |
3 mL乙醇、2 mL乙酸 |
0.1 |
|
| C |
3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1 H2SO4 |
1.2 |
|
| D |
3 mL乙醇、2 mL乙酸、盐酸 |
1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是__________mL和__________mol·L-1。
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是。
如图在试管A中先加入2mL的甲,并在摇动下缓缓加入2mL乙,充分摇匀,冷却后再加入丙,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管B中加入5ml丁溶液,按图连接好装置,用酒精灯对试管A小火加热3~5min后,改用大火加热,当观察到B试管中有明显现象时停止实验。试回答:
(1)写出下列物质的化学式(不用指出浓度)
甲乙
丙丁
(2)甲物质所含官能团的名称为
(3)写出试管A中发生反应的化学方程式
(4)若用18O标记乙醇中的氧元素,则18O会出现在哪种生成物中?
(5)试管甲中加入浓硫酸的主要目的是
(6)B中长导管不宜伸入试管的溶液中,原因是
(7)B中使用丁溶液的作用是
(17分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。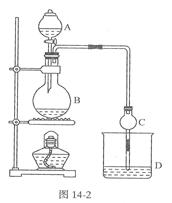
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
第5页
请回答:
(1)浓硫酸的作用是;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:。
(2)球形干燥管C的作用是。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示);反应结束震荡静止后D中的现象是.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;再加入(此空从下列选项中选择),然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
| A.五氧化二磷 | B.碱石灰 | C.无水硫酸钠 | D.生石灰 |
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH3”,来确定副产物中存在乙醚。请你对该同学的观点进行评价:。