已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验: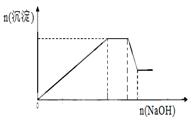
第一步:加入过量的稀盐酸,无沉淀生成。
第二步:继续加入过量的稀硫酸,有白色沉淀生成。
第三步:过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,
在此过程中溶液沉淀量的变化如右图所示,加热该溶液,
可产生使湿润的红色石蕊试纸变蓝色的气体。
根据以上实验现象回答下列问题:
(1)该待测液中一定含有 离子,一定没有 离子,可能有 离子。
(2)某同学采用测pH的方法来判断滴入NaOH溶液后是否使溶液呈碱性,该实验操作是 。
(3)第三步中产生使湿润红色石蕊试纸变蓝色的气体的离子方程式为 ,该步骤中预
期会出现另外一个特殊的实验现象,该现象对应的化学方程式为 。
下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
| 4 |
⑩ |
⑾ |
⑿ |
(1)写出下列元素的元素符号:① ② ⑾
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 。
(4)在③与④的单质中,化学性质较活泼的是 ,判断依据是 ;在⑧与⑿的单质中,化学性质较为活泼的是 ,判断依据是
分子式为C12H14O2的F有机物广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线: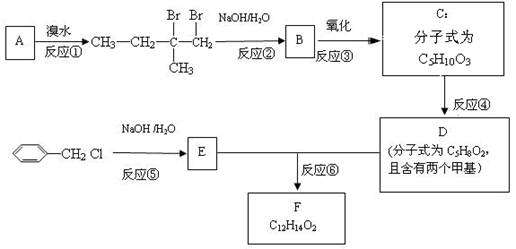
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现种峰;峰面积比为
(2)C物质的官能团名称
(3)上述合成路线中属于取代反应的是(填编号);
(4)写出反应④、⑤、⑥的化学方程式:
④
⑤
⑥
(5)F有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH2COOCH3;
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
⑴已知BA5为离子化合物,写出其电子式.
⑵B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形
⑶某同学根据上述信息,推断C基态原子的核外电子排布为:
该同学所画的电子排布图违背了.
⑷G位于族区,价电子排布式为.
⑸DE3 中心原子的杂化方式为,用价层电子对互斥理论推测其空间构型为.
⑹检验F元素的方法是,请用原子结构的知识解释产生此现象的原因是.
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为,该单质晶体中原子的堆积方式为四种基本模式中的.
高纯硅是当今科技的核心材料。工业上,用氢气还原四氯化硅制得高纯硅的反应为SiCl4(g)+2H2(g) Si(s)+4HCl(g)。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g)。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: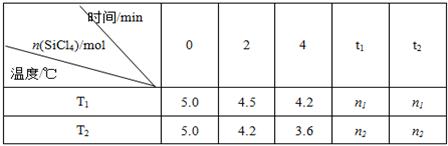
(1)T1时,反应开始的2 min内,用HCl表示的反应速率为。
(2)该反应的平衡常数表达式为:K=。
(3)保持其他条件不变,下列措施可提高SiCl4转化率的是 。
a.充入更多的SiCl4(g)
b.充入更多的H2(g)
c.及时分离出Si(s)
d.使用催化剂
e.将容器的体积扩大一倍
(4)据上表中的数据分析:T1T2(填“>”或“<”,下同),理由是。已知n1>n2,ΔH0。
(5)有同学认为,采用水淋法来吸收生成的HCl,可以提高SiCl4的转化率。该认识(填“合理”或“不合理”),理由是。
(6)将平衡后的混合气体溶于水,取少量上层清液,向其中滴加足量的AgNO3溶液,反应后过滤,取沉淀向其中加入Na2S溶液,可观察到。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如图所示。
请回答下列问题:
(1)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,则B的化学式可能为。(写出一种即可)
(2)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,则A的电子式为,B的结构式为。
(3)若D为氯碱工业的重要产品,反应(III)的离子方程式为。
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂。
①25℃时,pH均为10的A、B两溶液中,由水电离出的氢氧根离子浓度之比为。
②25℃时,0.1mol·L-1的A、B、C三种溶液,分别用水稀释不同的倍数后,溶液的pH相同,则稀释后溶液的物质的量浓度最大的是溶液(填溶质的化学式)。
③将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小顺序为。