二氧化氯(ClO2)是一种广谱、高效的杀菌消毒剂,有与氯气相似的强烈刺激性气味,易溶于水,沸点11℃,遇热不稳定易分解发生爆炸。一种工业制法用硫铁矿(主要成分为FeS2)还原氯酸钠制取二氧化氯,某研究小组在实验室设计如下装置制备ClO2的水溶液。
(1)三颈烧瓶中加入NaClO3溶液、浓H2SO4,通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。反应开始时烧瓶内发生反应的离子方程式如下,请配平该方程式:□ClO3- +□FeS2+□H+=□ClO2+□Fe3++□SO42-+□H2O
(2)装置D的作用是 。
(3)用上述反应完后的废液(除上述产物外,还有Al3+、Mg2+、H+、Cl-等)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下: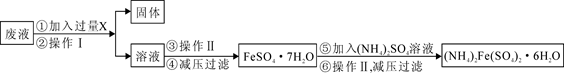
回答下列问题:
①操作Ⅰ的名称为: 。
②试剂X是 ,写出发生的主要反应的离子方程式 。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4_被还原成Mn2+。测得消耗KMnO4溶液的平均体积为21.00mL。则该晶体中铁的质量分数为 。(保留4位有效数字)
下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质,B是一种红棕色固体。(反应过程中生成的水及其他产物已略去)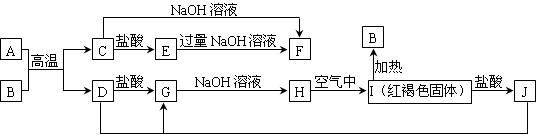
请回答以下问题:
(1)B是,H是,I是,F是。(填化学式)
(2)写出A和B的反应的化学方程式为。:
(3)写出J与D反应转化为G的离子方程式。
气体A的产量是衡量一个国家石油化工发展水平的标志,D是食醋中的主要成分。A能发生以下转化: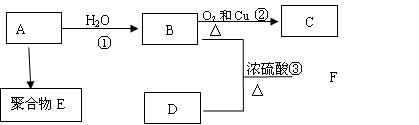
(1)A的结构简式为: 。
(2)E是(写结构简式);D中含官能团名称;
(3)写出相应转化过程的反应化学方程式
②: 反应类型: 反应
③:反应类型: 反应
用铜片、锌片和200mL稀H2SO4等组成原电池(如右图)。若整个实验过程有6.5 g锌溶解,此时H2SO4恰好全部用完。回答下列问题:
写出正极的电极反应式,正极发生的现象是,负极的电极反应式为。
(2)试计算:铜片上共放出L气体(标准状况),整个实验过程转移电子mol,稀硫酸的物质的量浓度为mol/L。
主族元素A、B、C、D、E的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体F。此液体与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。E的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水。回答下列问题:
⑴写出元素符号A, C。
⑵E元素的最高价氧化物和盐酸反应的离子方程式为:。
⑶用电子式表示F的形成过程。
在加热的条件下B、D形成的化合物的电子式为,其中的化学键的类型为。
⑷写出一种有A、B、C、D组成的化合物的化学式。
(5)B的气态氢化物是天然气的主要成分,它的空间结构为。
(15分)如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
Ⅰ.硫酸具有A-D所示的性质,以下过程主要表现了浓硫酸的那些性质?请将选项字母填在下列各小题的括号内:
A强酸性 B 吸水性 C 脱水性 D 强氧化性
(1)浓硫酸可以干燥氢气()
(2)浓硫酸使木条变黑()
(3)热的浓硫酸与铜片反应()
Ⅱ.现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有(选填序号),还缺少的仪器有
(写仪器名称);
(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用(选填①10mL、②50mL 、③100mL)规格的量筒;